- Διδάσκων: Κατερίνα Δημητρακοπούλου
Διαθέσιμα μαθήματα
Perilipsi
- Διδάσκων: Μαρία Χριστίνα Βορκά
- Διδάσκων: Αλέξιος Σωτήριος Γκένωσης Βαγενάς
- Διδάσκων: Παναγιώτης Κόλλιας
Περιγραφή
Κατά την διδασκαλία των δύο ενοτήτων "Ομοιόσταση" και "Ασθένειες" οι μαθητές έρχονται αντιμέτωποι με καινούργιες ορολογίες και έννοιες όπως η ομοιόσταση, τα μικρόβια, οι παθογόνοι μικροοργανισμοί κ.α. Σκοπός του μαθήματος είναι η αποσαφήνιση και η εξοικείωση των μαθητών με αυτές τις έννοιες μέσω οπτικοακουστικού υλικού αλλά και δραστηριοτήτων, τόσο ατομικών όσο και ομαδικών.Στόχοι μαθήματος
Μετά την παράδοση των μαθημάτων, οι μαθητές θα πρέπει να ξέρουν:
- Τι είναι η ομοιόσταση και πως λειτουργούν οι μηχανισμοί που τη ρυθμίζουν
- Τι είναι η ασθένεια και ποιοι παράγοντες την προκαλούν
- Πως ορισμένοι μικροοργανισμοί προκαλούν ασθένειες
- Πως μεταδίδονται οι μολυσματικές ασθένειες και πως μπορούμε να προφυλαχθούμε από αυτές
Ώρες διδασκαλίας: 4
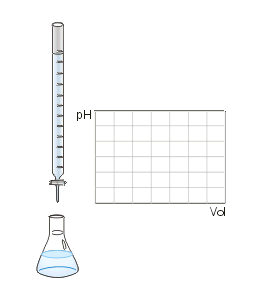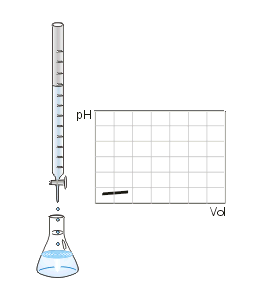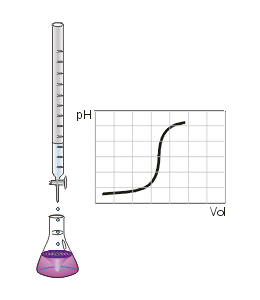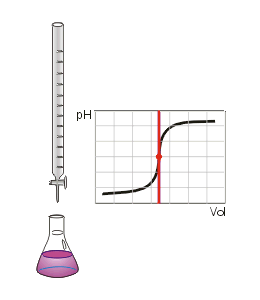
- Διδάσκων: Μαρία-Άννα Μενύχτα
Περιγραφή Μαθήματος
Το παρόν μάθημα έχει ως στόχο την εξοικόιωση των μαθητών/τριών με την έννοια των οξέων στο πλαίσιο της χημείας όπως και με τις έννοιες του pH, του όξινου χαρακτήρα, των δεικτών, της οξύτητας και του κατιόντος υδρογόνου.
Στόχοι Μαθήματος
- Να διαπιστώνετε τον όξινο χαρακτήρα ουσιών που περιέχονται σε προϊόντα του άμεσου περιβάλλοντός σας.
- Να ορίζετε τα οξέα κατά τον Arrhenius.
- Να γράφετε τους μοριακούς τύπους ορισμένων οξέων, όταν δίνονται τα ονόματά τους.
- Να ονομάζετε ορισμένα οξέα, όταν δίνονται οι μοριακοί τύποι τους.
- Να γράφετε τις χημικές εξισώσεις σχηματισμού ιόντων κατά τη διάλυση ορισμένων οξέων στο νερό.
- Να μετράτε το pH ενός διαλύματος με το πεχαμετρικό χαρτί.
Έννοιες Κλειδιά
oξύ, όξινος χαρακτήρας, δείκτες, κατιόν υδρογόνου, κλίμακα pH, οξύτητα

- Διδάσκων: Μαρία Καλογρίδη
- Διδάσκων: Χρήστος Ρίγλης
Οι μαθητές και οι μαθήτριες μετά το τέλος του μαθήματος θα μπορούν:
- να συνδέουν τις γνώσεις τους για τα οξέα, τις αλκοόλες και την αντίδραση εστεροποίησης με τα λίπη και έλαια
- να εξηγούν την απορρυπαντική δράση των σαπουνιών
- να παρασκευάζουν σαπούνι στο εργαστήριο.
Προαπαιτούμενες γνώσεις
- αλκοόλες
- οξέα
- αντίδραση εστεροποίησης

- Διδάσκων: Θεοφανώ-Αντωνία Πόταρη
Προαπαιτούμενες γνώσεις των μαθητών:
- Οι έννοιες: ηλεκτρόνιο, πυρήνας ατόμου, πρωτόνιο, νετρόνιο
Στόχοι του μαθήματος:
- Η εξοικείωση των μαθητών με τα γνωστότερα ατομικά μοντέλα δόμησης
- Η σωστή χρήση του μοντέλου Bohr σε ρεαλιστικά παραδείγματα
- Η εξοικείωση με τις έννοιες του μαζικού και ατομικού αριθμού
- Η συσχέτιση των παραπάνω με τα βασικά δομικά σωματίδια
- Η αναγνώριση ισοτόπων ατόμων
- Η διασαφήνισητης έννοιας του Ar
Απαιτούμενες ώρες διδασκαλίας για την κάλυψη της ύλης: 4 ώρες των 45 λεπτών
- Διδάσκων: Αντωνία-Μαρία Χαραλαμπίδη
ΣΤΟΧΟΣ ΤΟΥ ΜΑΘΗΜΑΤΟΣ
Μετά τo πέρας της διδασκαλίας της παρούσας ενότητας ο μαθητής θα πρέπει να μπορεί:
Βασικά θέματα
- Οι θεωρίες των Λαμάρκ και Δαρβίνου.
- Χρήσιμες αποσαφηνίσεις για την θεωρία της φυσικής επιλογής(Θεωρία Δαρβινού) και εφαρμογή της.
- Η σύγχρονη σύνθεση και οι παράγοντες που επηρεάζουν την εξελικτική πορεία.
- Φυλογένεση και από που αντλούμε στοιχεία.
- Εξέλιξη ανθρώπου και το γενεαλογικό δέντρο μας.
- Εμφάνιση θηλαστικών και πρωτευόντων και τα χαρακτηριστικά τους.
- Εμφάνιση Ανθρωπιδών και η ποικιλομορφία στους ανθρώπινους πολιτισμούς.
ΔΙΔΑΚΤΙΚΕΣ ΩΡΕΣ: 6

- Διδάσκων: Παύλος-Εμμανουήλ Πιτσιτάκης
- Διδάσκων: Χρήστος Τσάτσης
- Διδάσκων: Αλέξανδρος Χαριτωνίδης
Στο τέλος της παρούσας διδακτικής ενότητας ο μαθητής πρέπει να είναι σε θέση:
Στο τέλος της παρούσας διδακτικής ενότητας ο μαθητής πρέπει να είναι σε θέση:
- Να κατονομάζει τα συστατικά των ατόμων και να αναφέρεις τα βασικά γνωρίσματα των υποατομικών σωματιδίων.
- Να ορίζει τον ατομικό και το μαζικό αριθμό ενός ατόμου.
- Να δίνει τον ορισμό των ιόντων.
- Να αναφέρει παραδείγματα ουσιών που αποτελούνται από άτομα, μόρια, ιόντα.
- Να ερμηνεύει την αγωγιμότητα ορισμένων διαλυμάτων.

- Διδάσκων: Ιωάννα Κοροπούλη
Περιγραφή
Στο κεφάλαιο αυτό ο μαθητής εξοικειώνεται με την έννοια του ιδανικού αερίου, μαθαίνει να προβλέπει τις μεταβολές των αερίων μεταβάλλοντας τις συνθήκες τους και εφαρμόζει την καταστατική εξίσωση για την επίλυση προβλημάτων.
Στόχοι: Κατάκτηση της γνώσης και επίλυση ασκήσεων που αφορούν τα ακόλουθα θέματα κινητικής των αερίων:
- Νόμοι των Boyle, Charles, Gay- Lussac
- Ιδανικά αέρια
- Καταστατική εξίσωση ιδανικών αερίων
Πιο αναλυτικά οι μαθητές θα πρέπει:
- Να μπορούν να διαχωρίζουν τις συνθήκες εφαρμογής κάθε νόμου
- Να αναγνωρίζουν αν τα μεγέθη είναι ανάλογα ή αντιστρόφως ανάλογα, δηλαδή να εφαρμόζουν τους νόμους
- Να αντλούν δεδομένα και να σχεδιάζουν διαγράμματα
- Να γνωρίζουν την ορολογία που τους περιβάλλει
- Να αναγνωρίζουν τις συνθήκες που τους επιτρέπουν τη χρήση της καταστατικής εξίσωσης
- Να υπολογίζουν ορθά τα ζητούμενα μεγέθη με βάση την καταστατική εξίσωση των ιδανικών αερίων
- Να διαχειρίζονται συνθετότερα προβλήματα
- Να μπορούν να υπολογίζουν μεγέθη που προκύπτουν από διαδοχικές μεταβολές
Διδακτικές Ώρες: 5
- Διδάσκων: Ελένη Κυδωνάκη
- Διδάσκων: ΚΛΕΟΝΙΚΗ ΜΙΤΙΛΗ
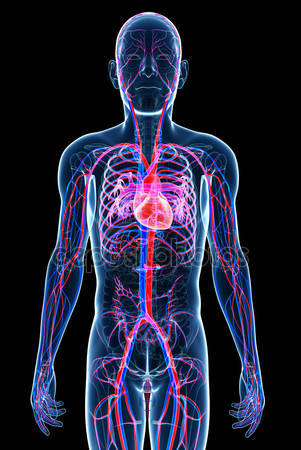
Με το πέρας της διδασκαλίας της ενότητας, ο μαθητής θα πρέπει να είναι εξοικειωμένος με:
- Τον ρόλο του κυκλοφορικού συστήματος στον ανθρώπινο οργανισμό
- Την λειτουργική σχέση μεταξύ της καρδιάς και των αιμοφόρων αγγείων
- Την διάκριση των ειδών των αιμοφόρων αγγείων και την περιγραφή τους
- Την λειτουργία και την σημασία της πίεσης του αίματος
- Τις συμπεριφορές που βελτιώνουν την υγεία του κυκλοφορικού συστήματος
- Διδάσκων: Ελένη-Νίκη Στεφάνου
ΣΤΟΧΟΙ
Σύμφωνα µε το Πρόγραμμα Σπουδών, μετά τη διδασκαλία αυτής της ενότητας ο μαθητής θα πρέπει να ξέρει:
ΠΡΟΑΠΑΙΤΟΥΜΕΝΕΣ ΓΝΩΣΕΙΣ:
Σύμφωνα µε το Πρόγραμμα Σπουδών, πριν τη διδασκαλία αυτής της ενότητας ο μαθητής πρέπει να ξέρει ότι:
- Το αίμα αποτελείται από πλάσμα, ερυθροκύτταρα, λευκοκύτταρα και αιμοπετάλια.
- Κάποια κύτταρα μπορούν να κάνουν φαγοκυττάρωση.
- Ο ανθρώπινος οργανισμός αποτελείται από διάφορα συστήματα, όπως το νευρικό, το πεπτικό, το κυκλοφορικό και το ενδοκρινικό.
ΔΙΔΑΚΤΙΚΟΙ ΣΤΟΧΟΙ:
- Να μπορούν οι μαθητές να διακρίνουν τους εσωτερικούς από τους εξωτερικούς αμυντικούς μηχανισμούς του οργανισμού.
- Να κατανοήσουν την διαδικασία με την οποία αντιμετωπίζει το ανθρώπινο σώμα τις ασθένειες, έχοντας εμπεδώσει τις έννοιες της “ανοσολογικής απόκρισης” και της “ανοσίας”.
- Να γνωρίσουν την λειτουργία και την προσφορά του εμβολιασμού.
- Να κατανοήσουν τον τρόπο με τον οποίο φτάνει ο ανθρώπινος οργανισμός στον εθισμό, καθώς και ποιες είναι οι επιπτώσεις της ψυχοσωματικής αυτής κατάστασης στο άτομο.
- Να διαχωρίσουν τις έννοιες “ψυχική” και “σωματική” εξάρτηση.
- Να αντιληφθούν τον κίνδυνο των εξαρτησιογόνων ουσιών και την φθορά του δυσλειτουργικού τρόπου ζωής.
ΔΙΔΑΚΤΙΚΕΣ ΩΡΕΣ: 6
Διδάσκοντες: Ευανθία Αντωνία Φραγκονικολάκη, Έλλη Πούτα, Στυλιανή Σταύρου

- Διδάσκων: Σταύρου Στυλιανή
Περιγραφή Μαθήματος
Το παρόν μάθημα έχει ως σκοπό την εξοικείωση του/της μαθητή/τριας με έννοιες όπως η ομοιόσταση και η κατανόηση των μηχανισμών της. Επιπλέον ο/η μαθητής/τρια έρχεται σε επαφή με την έννοια των ασθενειών, των τρόπων μετάδοσης καθώς και τους παράγοντες που τις προκαλούν.
Στόχοι Μαθήματος
Στο τέλος αυτής της διδακτικής ενότητας ο μαθητής θα μπορεί να γνωρίζει:
- Να ορίζουν την έννοια της ομοιόστασης.
- Να περιγράφουν τη λειτουργία των μηχανισμών που ρυθμίζουν
την ομοιόσταση.
- Να γνωρίζουν έννοιες που σχετίζονται με τις ασθένειες
(παθογόνος μικροοργανισμός, ξενιστής, μόλυνση, περίοδος επώασης κ.ά.).
- Να συσχετίζουν την ασθένεια με την πρόκληση διαταραχών της ομοιόστασης.
- Να διακρίνουν τους διαφορετικούς τρόπους πρόκλησης ασθενειών από τους μικροοργανισμούς καθώς και ποιες ασθένειες προκαλούν.
- Να περιγράφουν τον τρόπο μετάδοσης μολυσματικών ασθενειών.
Προαπαιτούμενες γνώσεις
- Συστατικά αίματος
- Τα διάφορα συστήματα από τα οποία αποτελείται ο ανθρώπινος οργανισμός (πεπτικό, νευρικό, κυκλοφορικό, ενδοκρινικό)
Ώρες διδασκαλίας: 6

- Διδάσκων: Δήμητρα-Ευγενία Αργυράκου
- Διδάσκων: Παναγιώτα Μαρκουλή
- Διδάσκων: Ιωάννης Παλόγλου
Περιγραφή και στόχοι μαθήματος
Στο μάθημα αυτό θα παρουσιαστεί η ενότητα 2.10 και 2.11 από το σχολικό βιβλίο της Χημείας της Β’ Γυμνασίου. Συγκεκριμένα από τη γενική ενότητα «Από το νερό στο άτομο- Από το μακρόκοσμο στο μικρόκοσμο» , θα διδαχθούν τα σύμβολα χημικών στοιχείων και χημικών ενώσεων και η χημική εξίσωση.
Με το πέρας αυτής της διδακτικής ενότητας ο μαθητής θα πρέπει :
να αναγνωρίζει και να γράφει τα σύμβολα ορισμένων χημικών στοιχείων και χημικών ενώσεων
να προσδιορίζει την ποιοτική σύσταση και την αναλογία ατόμων απλών χημικών ενώσεων από τους αντίστοιχους μοριακούς τύπους
να αναπαριστά ορισμένες απλές χημικές αντιδράσεις με προσομοιώματα μορίων και με χημικές εξισώσεις.
να αναγνωρίζει τα αντιδρώντα και τα προϊόντα σε μια χημική εξίσωση
να ισοσταθμίζει με τους κατάλληλους συντελεστές τις χημικές εξισώσεις
Απαιτούμενες διδακτικές ώρες για την κάλυψη της ύλης: 5
- Διδάσκων: Αντωνία Παπουτσά
- Διδάσκων: Ευανθία- Σεϊντή
Χημεία Γ΄Λυκείου
"Δομή οργανικών ενώσεων-διπλός και τριπλός δεσμός- Επαγωγικό φαινόμενο"
Περιγραφή
Σε αυτό το μάθημα θα παρουσιαστεί η ενότητα 7.1 του σχολικού βιβλίου της Χημείας Γ΄ Λυκείου.
Στόχοι
Στο τέλος αυτής της διδακτικής ενότητας ο μαθητής θα πρέπει:
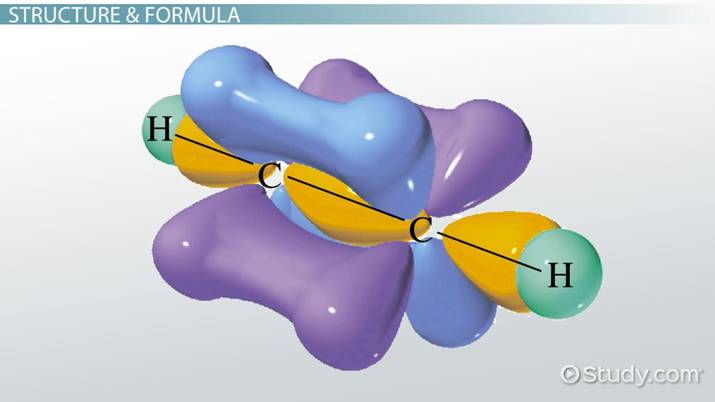
- Να γνωρίζει τις βασικές αρχές της θεωρίας δεσμού σθένους και της θεωρίας των μοριακών τροχιακών καθώς και τις μεταξύ τους διαφορές.
- Να εξηγεί ποιος είναι ο σ δεσμός και ποιος ο π δεσμός και να αναγνωρίζει τα δύο αυτά είδη δεσμών σε ορισμένα μόρια.
- Να εξηγεί τι είναι υβριδισμός. Να διακρίνει τις διάφορες κατηγορίες υβριδικών τροχιακών, καθορίζοντας τη γεωμετρική τους διάταξη και δίνοντας σχετικά παραδείγματα. Να ερμηνεύει με βάση τα προηγούμενα το σχηματισμό του απλού δεσμού C-C, του διπλού δεσμού C=C και του τριπλού δεσμού C≡C.
- Να αναγνωρίζει τη σημασία του επαγωγικού φαινομένου για την ερμηνεία ορισμένων ιδιοτήτων χημικών ενώσεων.
Προαπαιτούμενες γνώσεις:
- Ηλεκτρονιακή δομή ατομών
- Ατομικά τροχιακά
- Ηλεκτραρνητικότητα
Απαιτούμενες ώρες για την κάλυψη της ύλης: 6
- Διδάσκων: Μαρία Κουκή
- Διδάσκων: Κωνσταντίνος Λαθήρας
- Διδάσκων: Χριστίνα Λάλα
Χημεία Γ΄ Λυκείου
Ηλεκτρονιακή δομή των ατόμων και Περιοδικός πίνακας
Τροχιακό - κβαντικοί αριθμοί
Περιγραφή
Στο μάθημα θα παρουσιαστεί η ενότητα 6.1 "Τροχιακό - κβαντικοί αριθμοί" του σχολικού βιβλίου Χημείας Γ΄ Λυκείου.
Στόχοι
Στο τέλος της διδακτικής αυτής ενότητας θα πρέπει ο μαθητής να έχει κατανοήσει και να περιγράφει βασικές έννοιες του κβαντικού μοντέλου , όπως:- Ατομικό πρότυπο του Bohr (μηχανική & οπτική συνθήκη)
- Εξίσωση Planck
- Κυματική θεωρία της ύλης του de Broglie
- Αρχή της αβεβαιότητας του Heisenberg
- Κυματική εξίσωση του Schrödinger
- Τροχιακό
- Κβαντικοί αριθμοί (σημασία και δυνατές τιμές)
και να είναι σε θέση να λύσει εφαρμογές και πιο συνέθετες ασκήσεις
Ώρες διδασκαλίας για την κάλυψη της ύλης: 4
- Διδάσκων: Μαντέλος Kωνσταντίνος
- Διδάσκων: Παναγιώτης-Άγις Αδαμόπουλος
Περιγραφή
Στο συγκεκριμένο μάθημα θα παρουσιαστεί η Ενότητα 1.5 του σχολικού βιβλίου Χημείας Α' Λυκείου εμπλουτισμένη με πρόσθετο υλικό για να διευκολύνει τους μαθητές στην κατανόηση του περιεχομένου της.
Στόχοι του μαθήματος:
- Κατανόηση των βασικών εννοιών όπως μίγματα, χημική ένωση, χημικό στοιχείο, διαλυτότητα, περιεκτικότητα κ.τ.λ.
- Ταξινόμηση της ύλης σε κατηγορίες και κατανόηση των διαφορών τους.
- Διαχωρισμός ομογενών από ετερογενή μείγματα.
- Αναγνώριση των διαλυμάτων καθώς και των συστατικών τους.
- Έκφραση της περιεκτικότητας των διαλυμάτων και υπολογισμός αυτής.
- Ορισμός της διαλυτότητας σε συγκεκριμένο διαλύτη και των παραγόντων που την επηρεάζουν.
- Διαχωρισμός των διαλυμάτων με βάση την ποσότητα της διαλυμένης ουσιάς (κορεσμένα, ακόρεστα και υπέρκορα).
- Διδάσκων: Αικατερίνη Γεωργαλά
- Διδάσκων: Αγγελική Μουσουρούλη
Στο συγκεκριμένο μάθημα θα προσεγγιστούν οι έννοιες:
- Γενικά για τον χημικό δεσμό.
- Παράγοντες που καθορίζουν τη χημική συμπεριφορά του ατόμου.
- Είδη χημικών δεσμών, ιοντικός και ομοιοπολικός(πολικός-μη πολικός).
- Η γλώσσα της χημείας. Αριθμός οξείδωσης.
- Γραφή χημικών τύπων και μοριακων τύπων.
Η προσέγγιση θα γίνεται με διαδραστικά μέσα για να είναι ευχάριστη.
Στόχος του μαθήματος είναι να μπορέσεις:
- Να ορίζεις τι είναι χημικός δεσμός και να ταξινομείς τους χημικούς δεσμούς σε κατηγορίες.
- Να διακρίνεις τις διαφορές μεταξύ του ομοιοπολικού και ιοντικού δεσμού
- Να συνδέεις τις διαφορές αυτές με τις αντίστοιχες ιδιότητες των ομοιοπολικών και ιοντικών ενώσεων.
- Να ορίζεις τι είναι αριθμός οξείδωσης και να υπολογίζεις τον αριθμό οξείδωσης ενός στοιχείου σε μια ένωση.
- Να γράφεις τους ηλεκτρονιακούς τύπους ορισμένων απλών μορίων.
- Να μιλάς και να γράφεις τη γλώσσα της χημείας των ανόργανων ενώσεων.
Προαπαιτούμενες γνώσεις
- Γνώσεις Χημείας παλαιότερων χρόνων.
- Γνώση επίλυσης στοιχειωδών μαθηματικών προβλημάτων μέσω αριθμητικής.
Ώρες διδασκαλίας:6 Διδάσκοντες: Αστερίου Ζωή, Δημητρέλου Αθανασία Κουτσουμπού Παναγιώτα.
- Διδάσκων: Παναγιώτα Κουτσούμπου
Βασικός στόχος του μαθήματος:
Στο τέλος της εκπαιδευτικής διαδικασίας ο μαθητής θα κατέχει βασικές γνώσεις για τα αλκάνια και ιδίως για φυσικό αέριο. Παράλληλα θα βρίσκεται σε θέση να αναπαράγει και να περιγράφει τις βασικές αντιδράσεις του αιθινίου και θα αντιμετωπίζει με ευχέρεια προβλήματα καύσεων υδρογονανθράκων.
Πιο συγκεκριμένα το μαθημα χωρίζεται σε 2 κεφάλαια:
- Περιγραφή του συντακτικού τύπου των αλκανίων
- Φυσικές και Χημικές ιδιότητες
- Ανάλυση καύσεων αλκανίων
- Χρησεις αλκανίων στην καθημερινότητα
- Προεύλεση και σύσταση του φυσικού αερίου
- Χρησιμότητα
- Γενικά για τα αλκίνια (συντακτικός τύπος,ονοματολογία,...)
- Συντακτικός τύπος και δομή του αιθινίου
- Φυσικές και χημικές ιδιότητες
- Χρήσεις στην καθημερινή ζωή
Ώρες μαθήματος: 4 ώρες συν 2 ώρες συμπλήρωσης φύλλου εργασίας
Διδάσκοντες: Σάλλο Μάριος, Τσιλιφώνης Εμμανουήλ

- Διδάσκων: Μάριο Σάλλο
Στόχοι
Οι μαθητές, στο τέλος των 4 διδακτικών ωρών θα πρέπει να είναι σε θέση να:
- Απαριθμούν τα κυριότερα συστατικά του πετρελαίου και του φυσικού αερίου. Να περιγράφουν με συντομία τη διαδικασία σχηματισμού των κοιτασμάτων του πετρελαίου και του φυσικού αερίου.
- Αναφέρουν σε τι αποσκοπούν η αποθείωση και η κλασματική απόσταξη του πετρελαίου.
- Συγκρίνουν ως καύσιμα το πετρέλαιο και το φυσικό αέριο.
- Αναφέρουν πετροχημικά προϊόντα που βρίσκονται στο περιβάλλον τους.
- Αποδίδουν τον πολυμερισμό με χημικές εξισώσεις και προσομοιώματα.
- Διακρίνουν τα πλαστικά από τα πολυμερή.
- Συνεκτιμούν τα πλεονεκτήματα και τα μειονεκτήματα των συνθετικών πολυμερών για συγκεκριμένες εφαρμογές.
- Αναφέρουν παραδείγματα γνωστών από την καθημερινή ζωή ζυμώσεων
- Αναφέρουν το συντακτικό τύπο και τις φυσικές ιδιότητες και να αναγράφουν τη χημική εξίσωση της καύσης της αιθανόλης.
- Συσχετίζουν τη δράση ενζύμων και καταλυτών.
- Αναφέρουν παραδείγματα αλκοολούχων διαλυμάτων και των πρώτων υλών από τις οποίες παρασκευάζονται.
- Εκτιμούν τις επιπτώσεις της κατάχρησης του αλκοόλ στον ανθρώπινο οργανισμό.
Προαπαιτούμενες Γνώσεις
- Βασικές γνώσεις της Οργανικής Χημείας και των οργανικών ενώσεων, λ.χ. υδρογονάνθρακες
- Η έννοια του διαλύματος και της ταχύτητας της αντίδρασης
Διδακτικές ώρες
Για την κάλυψη της παραπάνω ύλης απαιτούνται 4 διδακτικές ώρες, εκ των οποίων η 1 θα χρησιμοποιηθεί για την συμπλήρωση των φύλλων αξιολόγησης
Λέξεις Κλειδιά
Υδρογονάνθρακες, πετρέλαιο, φυσικό αέριο, πετροχημικά, πλαστικά, αιθανόλη, αλκοόλ, ένζυμα

- Διδάσκων: Εμμανουήλ Βαχατσάκης
- Διδάσκων: Ιωάννης Τσιάρας
ΣΤΟΧΟΙ
Μετά την διδασκαλία της συγκεκριμένης διδακτικής ενότητάς, ο μαθητής πρέπει:
- να γνωρίζει τον 3ο νόμο του Νεύτωνα (δράση - αντίδραση) και να ξεχωρίζει τις δυνάμεις εξ'επαφής και εξ'αποστάσεως.
- να μπορεί να αναλύσει μια δύναμη σε συνιστώσες αλλά και να προσδιορίζει τη συνισταμένη δύο ή περισσοτέρων δυνάμεων.
- να είναι σε θέση να χρησιμοποιήσει τις παραπάνω γνώσεις για επίλυση απλών προβλημάτων ισορροπίας.
- να εχει κατανοήσει την έννοια της τριβής, την διαφορά μεταξύ τριβής ολίσθησης και στατικής τριβής, καθώς και να μπορεί να υπολογίσει την τιμή της.
- Ευθύγραμμη ομαλή κίνηση.
- Ευθύγραμμη ομαλά μεταβαλλόμενη κίνηση.
- Έννοια βάρους-μάζας.
- Πρώτος νόμος του Νεύτωνα.
- Δεύτερος νόμος του Νεύτωνα ( θεμελιώδης νόμος της μηχανικής).
- Βασική τριγωνομετρία.
5 ώρες για την διδασκαλία της ενότητας και επίλυση ασκήσεων και 1 ώρα για κριτήριο αξιολόγησης.

- Διδάσκων: Ιωάννης Δαμιανίδης
- Διδάσκων: Παναγιώτης Κουρκούλης
Μετά την διδασκαλία αυτού του μαθήματος ο μαθητής θα μπορεί να:
- Αναγνωρίζει τα άλατα και να τα διακρίνει από τα οξέα και τις βάσεις.
- Γράφει τις ιοντικές εξισώσεις σχηματισμού των αλάτων
- Ορίσει την έννοια της διαλυτότητας και να διακρίνει τα ευδιάλυτα από τα δυσδιάλυτα άλατα
- Γνωρίζει τα οξέα, τις βάσεις και τα άλατα που συναντώνται στην καθημερινότητα
- Προβλέπει τι θα συμβεί κατά την επίδραση οξέων σε μέταλλα και άλατα
- Αναγνωρίζει τους κινδύνους που διέπουν την χρήση κάποιων οξέων και βάσεων
- Επιλέγει πότε θα πρέπει να χρησιμοποιήσει οξύ και πότε βάση
- Γνωρίσει την επίδραση του pH στις καλλιέργειες και κάτω από ποιες συνθήκες ευδοκιμεί κάθε φυτό
- Ορίσει την έννοια της όξινης βροχής και τις συνέπειες της στο περιβάλλον και τους ανθρώπους.
- Διδάσκων: Μαρία-Αλεξάνδρα Γουρζή
- Διδάσκων: Κατερίνα Μίχα
ΣΤΟΧΟΙ ΜΑΘΗΜΑΤΟΣ
Σύμφωνα µε το Πρόγραμμα Σπουδών, μετά τo πέρας της διδασκαλίας της παρούσας ενότητας ο μαθητής πρέπει να είναι σε θέση:
- Να διαπιστώνουν τον όξινο χαρακτήρα ουσιών που περιέχονται σε προϊόντα του άμεσου περιβάλλοντός σας
- Na ορίζουν τα οξέα κατά τον Arrhenius.
- Να γράφουν τους μοριακούς τύπους ορισμένων οξέων, όταν δίνονται τα ονόματά τους.
- Να ονομάζουν ορισμένα οξέα, όταν δίνονται οι μοριακοί τύποι τους.
- Να γράφουν τις χημικές εξισώσεις σχηματισμού ιόντων κατά τη διάλυση ορισμένων οξέων στο νερό.
- Να μετράνε το pH ενός διαλύματος με το πεχαμετρικό χαρτί

- Διδάσκων: Σωκράτης Βρέντζος
ΟΙ ΣΤΟΧΟΙ
Στο τέλος της διδακτικής αυτής ενότητας ο μαθητής θα πρέπει είναι σε θέση
- Να ξεχωρίζει από ένα σύνολο αλκοολών ποιες είναι μονοσθενείς και ποιες πολυσθενείς ή ποιες είναι πρωτοταγείς, ποιες δευτεροταγείς και ποιες τριτοταγεις.
- Να αναφέρει τις σημαντικότερες παρασκευές και χημικές ιδιότητες των κορεσμένων μονοσθενών αλκοολών (ειδικότερα της αιθανόλης), γράφοντας τις αντίστοιχες χημικές εξισώσεις. Να διακρίνει με βάση τη χημική τους συμπεριφορά τη διαφορά μεταξύ των πρωτοταγών, δευτεροταγών και τριτοτραγών αλκοολών. Να επιλύει προβλήματα στοιχειομετρίας που βασίζονται στις προηγούμενες χημικές εξισώσεις.
- Να αναφέρει τις σημαντικότερες χημικές ιδιότητες των καρβονυλικών ενώσεων, γράφοντας τις αντίστοιχες χημικές εξισώσεις. Να εντοπίζει με βάση τη χημική τους συμπεριφορά τις διαφορές μεταξύ των αλδεϋδών και κετονών.
- Να αναφέρει τις κυριότερες παρασκευές και χημικές ιδιότητες της φαινόλης γράφοντας τις αντίστοιχες χημικές εξισώσεις. Να επιλύει προβλήματα στοιχειομετρίας που βασίζονται στις προηγούμενες χημικές εξισώσεις.
ΔΙΔΑΚΤΙΚΕΣ ΩΡΕΣ
4 ώρες διδασκαλίας + 1 ώρα για κριτήρια αξιολόγησης + 1ώρα για εργαστηριακές ασκήσεις
ΠΡΟΑΠΑΙΤΟΥΜΕΝΕΣ ΓΝΩΣΕΙΣ
Ομόλογες σειρές οργανικών ενώσεων, Αλκένια, Ονομασία αρωματικών υδρογονανθράκων, Διάσταση ασθενών οξέων, Δεσμός υδρογόνου.
Στο κεφάλαιο αυτό θα μελετηθούν οργανικές ενώσεις που η λειτουργική ομάδα τους περιέχει οξυγόνο που συνδέεται με δύο απλούς δεσμούς (-Ο-). Τέτοιες ενώσεις είναι οι αλκοόλες και οι αιθέρες. Η λειτουργική ομάδα των αλκοολών είναι το υδροξύλιο ΟΗ, το οποίο συνδέεται με ένα άτομο άνθρακα, δηλαδή
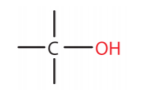
Η λειτουργική ομάδα της ομόλογης σειράς των αιθέρων είναι ένα άτομο οξυγόνου που συνδέεται με δύο άτομα άνθρακα
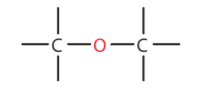 .
.
- Διδάσκων: Φρανκ-Νικόλας Κεραμιδάς
- Διδάσκων: Γεώργιος Κοτσιφάκος
ΣΤΟΧΟΙ
Σύµφωνα µε το Πρόγραµµα Σπουδών, µε τη διδασκαλία αυτής της ενότητας ο µαθητής πρέπει να µπορεί:
- Να διακρίνει τα συµπιεστά από τα ασυµπίεστα ρευστά.
- Να διατυπώνει µε λόγια και µε τύπους την εξίσωση της συνέχειας και το νόµο του Bernoulli και να τους χρησιµοποιεί στη λύση φυσικών προβληµάτων.
Ειδικότερα, κατά τη δική µας γνώµη, µετά τη διδασκαλία αυτού του κεφαλαίου ο µαθητής πρέπει:
- Να ανακαλέσει στη µνήµη τους την έννοια της υδροστατικής πίεσης και να γνωρίζει τις προϋποθέσεις υπό τις οποίες ισορροπεί ένα ρευστό.
- Να κατανοήσει ότι η εξίσωση της συνέχειας αποτελεί συνέπεια της αρχής διατήρησης της µάζας και ότι η εξίσωση του Bernoulli αποτελεί συνέπεια της αρχής διατήρησης της ενέργειας
- Να κατανοήσει ότι µεταξύ των µορίων των ρευστών αναπτύσσονται δυνάµεις που τείνουν να εµποδίσουν την κίνηση ενός τµήµατός του σε σχέση µε το υπόλοιπο υγρό.
Διδακτικές ώρες: 7
- Διδάσκων: Χριστόφορος Καλαντζής
- Διδάσκων: Ειρήνη Κόκλα
- Διδάσκων: Αντώνης Κωνστανταράκης
Ενότητα 7.3- Χημεία Γ' Λυκείου
Οι αντιδράσεις των οργανικών ενώσεων περιλαμβάνουν αρκετές κατηγορίες και δύνανται να ταξινομηθούν με βάση 2 βασικά κριτήρια, το μηχανισμό αλλά και το είδος της αντίδρασης.
Μετά το πέρας της διδασκαλίας της ενότητας, ο μαθητής θα πρέπει να είναι σε θέση να ταξινομήσει τις οργανικές αντιδράσεις με βάση τα προαναφερθέντα κριτήρια καθώς επίσης και να είναι σε θέση να συμπληρώσει τις χημικές εξισώσεις των χαρακτηριστικών αντιδράσεων που θα διδαχτεί.
Διδακτικές ώρες: 4 ώρες + 2 ώρες που θα χρησιμοποιηθούν κριτήρια αξιολόγησης και πειραματικές διαδικασίες
Προαπαιτούμενες γνώσεις:
- Ονοματολογία χημικών ενώσεων
- Ιδιότητες χαρακτηριστικών ομάδων και ταυτοποίηση
- Δομή οργανικών ενώσεων (διπλός και τριπλός δεσμός)
- Αριθμούς οξείδωσης χημικών στοιχείων
- Θεωρία Lewis και θεωρία Brönsted- Lowry για οξέα και βάσεις
- Οξειδοαναγωγικές αντιδράσεις - αποχρώσεις αντιδραστηρίων οξειδοαναγωγικών αντιδράσεων
- Διδάσκων: Ευγενία Παρτσαλίδη
- Διδάσκων: Νεφέλη Τσεμπέρη
Στο μάθημα αυτό θα παρουσιαστούν τα κεφάλαια 3.1, 3.3 και 3.4 του σχολικού βιβλίου της Φυσικής Β Λυκείου Γενικής Παιδείας. Ειδικότερα, αναλύονται η φύση του φωτός, το μήκος κύματος και η συχνότητά του, καθώς και η ανάλυση του λευκού φωτός και τα χρώματα.
Στόχοι
Μετά το τέλος του μαθήματος οι μαθητές θα πρέπει να είναι σε θέση :
- Να αντιλαμβάνονται και να ερμηνεύουν τη διπλή φύση του φωτός ως κύμα και ως σωματίδιο
- Να διατυπώνουν και να εφαρμόζουν το νόμο της ανάκλασης
- Να διαπιστώνουν πειραματικά τα φαινόμενα της ανάκλασης και διάθλασης του φωτός
- Να δείχνουν ότι η διεύθυνση της διάδοσης του φωτός αλλάζει, όταν μία φωτεινή δέσμη διέρχεται από διαφορετικά υλικά
- Να διατυπώνουν τον ορισμό του δείκτη διάθλασης και να κατανοούν την εξάρτηση του από το μήκος κύματος
- Να περιφράφουν το φαινομένο του διασκεδασμού
- Να αναλύουν το φάσμα του λευκού φωτός και να εντοπίζουν εφαρμογές του στη φύση
- Να γνωρίζει τις βασικές εφαρμογές της υπέρυθρης και της υπεριώδους ακτινοβολίας στην καθημερινή ζωή
Διδακτικές Ώρες
Οι απαιτούμενες ώρες διδασκαλίας για την κάλυψη της ύλης που αναφέρθηκε
είναι
8
- Διδάσκων: Χαϊδόγιαννου Μαριάννα
- Διδάσκων: Δανάη Παρισούλη
- Διδάσκων: Φοίβη Παρισούλη
ΠΕΡΙΓΡΑΦΗ
Στο συγκεκριμένο μάθημα θα παρουσιαστεί το Κεφάλαιο 4 του σχολικού βιβλίου Φυσικής Β' Γυμνασίου εμπλουτισμένο με επιπρόσθετο υλικό για την πλήρη κατανόησή του από τους μαθητές.
ΣΤΟΧΟΙ ΚΕΦΑΛΑΙΟΥ
Στο κεφάλαιο αυτό:
- Θα δώσουμε τον ορισμό της πίεσης και θα τον συγκρίνουμε με αυτόν της δύναμης.
- Θα προσεγγίσουμε την έννοια της υδροστατικής πίεσης, της ατμοσφαιρικής πίεσης και της άνωσης.
- Θα μελετήσουμε την μετάδοση των πιέσεων στα ρευστά, την Αρχή του Αρχιμίδη για την άνωση και την συνθήκη πλέυσης.
Για να μπορέσει ο μαθητής να παρακολουθήσει αυτό το μάθημα πρέπει να έχει:
- Στοιχειώδεις γνώσεις μαθηματικών και φυσικής των προηγούμενων τάξεων.
- Ευχέρεια στην χρήση υπολογιστών και ειδικότερα των ηλεκτρονικών προσομοιώσεων.
Για την κάλυψη του συγκεκριμένου κεφαλαίου θα αξιοποιηθούν 7 ώρες. Μέρος από αυτές θα χρησιμοποιηθεί για την επίλυση κριτήριων αξιολόγησης και την πραγματοποίηση εργαστηριακών ασκήσεων.
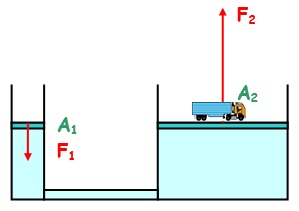
- Διδάσκων: Άννα-Μάρια Ταβλαρίδη
Μετά το πέρας αυτής της διδακτικής ενότητας, ο μαθητής θα είναι σε θέση να ταξινομούν τα χαρακτηριστικά των οργανισμών σε κληρονομικά και επίκτητα και να σχετίζει την ποικιλομορφία των οργανισμών ως την ανάγκη τους να προσαρμόζονται στο περιβάλλον τους. Στόχος είναι επίσης να μπορεί να περιγράφει τους νόμους του Μέντελ και να είναι σε θέση να περιγράφει τον τρόπο με τον οποίο κληρονομούνται τα χαρακτηριστικά από τον έναν οργανισμό στον άλλον.
Προκειμένου να μπορούν να εκπληρωθούν οι στόχοι του μαθήματος ο μαθητής πρέπει να έχει κάποιες προαπαιτούμενες γνώσεις. Αυτές είναι:
- Γνώση των δομικών υλικών των απαραίτητων μακρομορίων (νουκλεοτίδια, αμινοξέα)
- Τρόποι αναπαραγωγής των οργανισμών (μονογονία, αμφιγονία)
- Τι είναι το γενετικό υλικό και με ποια μορφή είναι αποθηκευμένο στους οργανισμούς
Ώρες διδασκαλίας: 4

- Διδάσκων: NIKOS KALOGEROPOULOS
- Διδάσκων: nikos kalogeropoulos
- Διδάσκων: Μαρία Πανταζίδου
- Διδάσκων: Κλέιντα Χύσα
Χημεία Γ΄ Γυμνασίου:
Ταξινόμηση στοιχείων- Στοιχεία με ιδιαίτερο ενδιαφέρον:
"Ο Περιοδικός Πίνακας- Τα αλκάλια- Μερικές ιδιότητες και χρήσεις μετάλλων"
Στόχοι του μαθήματος:
- Ο Περιοδικός Πίνακας
- Ο Περιοδικός Πίνακας
Ο μαθητής θα πρέπει:
- Τα αλκάλια
- Τα αλκάλια
- Τα αλκάλια
Ο μαθητής θα πρέπει:
- Μερικές ιδιότητες και χρήσεις των αλκαλίων
- Μερικές ιδιότητες και χρήσεις των αλκαλίων
- Μερικές ιδιότητες και χρήσεις των αλκαλίων
Ο μαθητής θα πρέπει:
Διδακτικές ώρες: 6
- Διδάσκων: Χριστίνα Ντερβίσι
- Διδάσκων: Στυλιανή Τζωρτζάτου
- Διδάσκων: Γεωργία Χελιδωνη
Χημεία Α' Λυκείου
Ενότητα 2.4:
Η γλώσσα της χημείας - Αριθμός οξείδωσης- Γραφή χημικών τύπων και εισαγωγή στην ονοματολογία των ενώσεων
Διαθέσιμο Υλικό Μαθήματος: Χημεία (A΄Λυκείου) - Βιβλίο Μαθητή, Οπτικοακουστικά μέσα (Moodle)
Διδακτικές Ώρες: 4

- Διδάσκων: Αγγελική Βαλσάμη
- Διδάσκων: Γιάννης Κούτχιας
Το παρόν μάθημα αποτελείται από τις εξής κύριες θεματικές ενότητες:
• Οξέα & Βάσεις (Κεφ. 5 παρ. 1)
• Ιοντική Ισορροπία, Επίδραση Κοινού Ιόντος & Ρυθμιστικά Διαλύματα (Κεφ. 5 παρ. 2, 3, 4 και 5)
• Δείκτες & Ογκομέτρηση (Κεφ. 5 παρ. 6)
Ακολουθούν αναλυτικά οι διδακτικοί στόχοι του μαθήματος.
Διδακτικοί Στόχοι:
Με το πέρας του μαθήματος, οι μαθητές/τριες θα γνωρίζουν/θα έχουν εξοικειωθεί με/θα είναι σε θέση να:
• Τον ορισμό των οξέων και των βάσεων κατά Arrhenius & κατά Brönsted-Lowry και τις οι διαφορές μεταξύ των δύο θεωριών. Ορισμός των συζυγών ζεύγων οξέος-βάσης.
• Τι είναι ο βαθμός ιοντισμού (α) και σταθερά ιοντισμού (Κx) και οι παραγόντες οι οποίοι επηρεάζουν τα δύο αυτά μεγέθη. Μελέτη των αντιδράσεων ιοντισμού ασθενών ηλεκτρολυτών (μονπρωτικών οξέων & βάσεων) και υπολογισμοί διαφόρων μεγεθών μέσω της σταθεράς ιοντισμού της αντίδρασης.
• Το δυναμικό υδρογόνου pH (potentia hydrogenii). Υπολογισμός του pH (πέ-χα) διαλυμάτων και χαρακτηρισμός των διαλυμάτων ως όξινα, βασικά/αλκαλικά ή ουδέτερα βάσει του pH τους.
• Την επίδρασης κοινού ιόντος (Ε.Κ.Ι.) στις αντιδράσεις ιοντισμού ασθενών ηλεκτρολυτών (μονπρωτικών οξέων & βάσεων).
• Τον ορισμό, τον μηχανισμός λειτουργίας, τον τρόπος παρασκευής & χρησιμότητα των ρυθμιστικών διαλυμάτων.
• Την ογκομετρική ανάλυση και η χρησιμότητα των δεικτών σε αυτή.

- Διδάσκων: Ορέστης- Πουλιάσης
Στη συγκεκριμένη θεματική ενότητα θα αναλυθούν οι φυσικές ιδιότητες και η χημεία του άνθρακα μέσα από διάφορες οργανικές ενώσεις.
Ειδικότερα τα κεφάλαια που διδάσκονται είναι:
- Εισαγωγή στους υδρογονάνθρακες
- Πετρέλαιο - Φυσικό Αέριο - Πετροχημικά
- Αιθανόλη
Επιπλέον, γίνεται εργαστηριακή άσκηση με θέμα τον προσδιορισμό της περιεκτικότητας διαλυμάτων σε αιθανόλη.
Τέλος, η αξιολόγηση του μαθήματος γίνεται με εξέταση (test) διάρκειας μιας διδακτικής ώρας.

- Διδάσκων: Δημήτριος Παδουβάς
- Διδάσκων: Γεώργιος Σαγιάς
Ο κάθε μαθητής και κάθε μαθήτρια μετά τα μαθήματα που θα ακολουθήσουν σε αυτό το κεφάλαιο θα μπορεί:
- να συνδέει προηγούμενες γνώσεις από τα οξέα, τις αλκοόλες και την αντίδραση της εστεροποίησης με τα λίπη και τα έλαια,
- να αντιληφθεί την απορρυπαντική δράση των σαπουνιών και
- να παρασκευάσει εργαστηριακά σαπούνι.
Προαπαιτούμενες γνώσεις
Οι μαθητές θα πρέπει να:
• γνωρίζουν τον γενικό τύπο των εστέρων και την αντίδραση εστεροποίησης.
• αναγνωρίζουν τους εστέρες από το μοριακό/συντακτικό τους τύπο.
• γνωρίζουν σε τι τιμές κυμαίνεται το pH των σαπουνιών-απορρυπαντικών και να το μετρούν με το πεχάμετρο.
• αναγνωρίζουν και να χρησιμοποιούν όργανα Χημείας όπως ο ογκομετρικός κύλινδρος, το ποτήρι ζέσεως, ο υδροβολέας, και ο τρίποδας λύχνος.
• χειρίζονται το λογισμικό «Moodle»
ΔΙΔΑΚΤΙΚΕΣ ΩΡΕΣ: 5

- Διδάσκων: Ειρήνη Σκυλλά
- Διδάσκων: Αγνή-Αρετή Φρέρη
ΧΗΜΕΙΑ Β' ΓΥΜΝΑΣΙΟΥ
Περιγραφή μαθήματος
Σε αυτό το μάθημα θα διδαχθούν οι ενότητες 3 και 4 του σχολικού βιβλίου της Χημείας Β' Γυμνασίου. Πιο συγκεκριμένα, το μάθημα μελετά τη σύσταση του ατμοσφαρικού αέρα και των επιμέρους συστατικών του και αναλύει τον όρο του εδάφους και του υπεδάφους.
Ακόμα, έχει ως στόχο να εξοικειώσει και να προβληματίσει τον μαθητή σχετικά με τη ρύπανση του άερα και του εδάφους.
Γενική ενότητα 3: Ατμοσφαιρικός Αέρας
3.1 Σύσταση του ατμοσφαιρικού αέρα3.2 Οξυγόνο
3.3 Διοξείδιο του άνθρακα
3.4 Η ρύπανση του αέρα
Γενική ενότητα 4: Το Έδαφος
4.1 Το έδαφος και το υπέδαφος4.2 Ρύπανση του εδάφους
Διδακτικές ώρες
Η διδασκαλία των παραπάνω ολοκληρώνεται σε 5 διδακτικές ώρες. Οι 4 ώρες χρησιμοποιούνται για την παράδοση της θεωρίας των κεφαλαίων και την επίλυση των φύλλων δραστηριότας που τα συνοδεύουν, ενώ η ώρα που απομένει αφιερώνεται στη διεξαγωγή του κριτηρίου αξιολόγησης.

- Διδάσκων: Nikos Kalogeropoulos
- Διδάσκων: Αθανάσιος Ασπροδίνης
- Διδάσκων: Γεωργία Θεοδωρέλη
Περιγραφή Μαθήματος
Η ενότητα αυτή πραγματεύεται την έννοια των χημικών αντιδράσεων.
Ειδικότερα θα συζητηθούν τα εξής θέματα:
- Πως συμβολίζονται ορθά οι χημικές αντιδράσεις
- Πότε συμβαίνει, πόσο γρήγορα συμβαίνει, τι ενεργειακές μεταβολές και τι αποτελεσματικότητα έχει μια χημική αντίδραση
- Οξειδοαναγωγικές Αντιδράσεις
- Αντιδράσεις Σύνθεσης
- Αντιδράσεις Αποσύνθεσης και Διάσπασης
- Αντιδράσεις Απλής Αντικατάστασης
- Μεταθετικές Αντιδράσεις
- Αντιδράσεις Διπλής Αντικατάστασης
- Εξουδετέρωση
- Διδάσκων: Σοφία Βογιατζή
- Διδάσκων: Άννα-Μαρία Κυπραίου
- Διδάσκων: Λυδία Μαντά
Βιολογία Β΄ Λυκείου
Ενότητα 1.2- Μακρομόρια: Γενικά Στοιχεία , Πρωτεΐνες, Νουκλεϊκά Οξέα, Λιπίδια, Υδατάνθρακες
ΣΤΟΧΟΙ:
Στο τέλος της μελέτης αυτού του κεφαλαίου θα μπορείτε:
- Να αναφέρετε τις σπουδαιότερες ομάδες βιολογικών μακρομορίων (πρωτεΐνες, νουκλεϊκά οξέα, υδατάνθρακες, λιπίδια) και να περιγράφετε τη δομή τους.
- Να διακρίνετε ομοιότητες στον τρόπο με τον οποίο σχηματίζονται τα διαφορετικά είδη μακρομορίων.
- Να αναγνωρίζετε ότι οι δομές και οι λειτουργίες που σχετίζονται με τις εκδηλώσεις της ζωής δεν είναι παρά προεκτάσεις της δομής, των ιδιοτήτων και των αλληλεπιδράσεων των μακρομορίων που συναντάμε σε ένα ζωντανό κύτταρο.
- Να γνωρίζει τους δομικούς λίθους των μακρομορίων μετά το πέρας της μελέτης.
- Να ξεχωρίζει τους μηχανισμούς της υδρόλυσης και της συμπύκνωσης.
Να κατανοεί πως ο κόσμος δομείται από αυτά και περιέχονται στον ανθρώπινο οργανισμό.
Nα εξοικειωθεί με την ιδέα να αναρωτιέται και να πειραματίζεται για να οδηγηθεί ο ίδιος στη γνώση.
Διδακτικές ώρες: 4-5
- Διδάσκων: Άννα Κατσίρου
- Διδάσκων: Ερασμία Κοψαχείλη
Περιγραφή μαθήματος
Στα επόμενα μαθήματα θα γίνει αναλυτική παρουσίαση των Κεφ. 6.2&6.3 του σχολικού βιβλίου. Αναλυτικότερα, θα διδαχθούν οι αρχές ηλεκτρονικής δόμησης των πολυηλεκτρονιακών ατόμων , η δομή του Περιοδικού Πίνακα και τα στοιχεία μετάπτωσης . Τέλος, θα γίνει συσχέτιση της θέσης ενός στοιχείου στον Περιοδικό Πίνακα και της ηλεκτρονικής δομής του .
Εκπαιδευτικοί στόχοι
- Να διατυπώνει τις τρεις αρχές ηλεκτρονιακής δόμησης οι οποίες είναι η απαγορευτική αρχή του Pauli , η αρχή της ελάχιστης ενέργειας και ο κανόνας του Hund και να ταξινομεί ενεργειακά τις υποστιβάδες.
- Να γράφει την ηλεκτρονιακή δομή ενός ατόμου γνωρίζοντας μόνο τον ατομικό του αριθμό.
- Να συσχετίζει την ηλεκτρονιακή δόμηση των ατόμων με την κατάταξη των στοιχείων στον περιοδικό πίνακα.
- Να διακρίνει τους τομείς s, p, d, f και να ξεχωρίζει τα στοιχεία που ανήκουν σε κάθε τομέα.
- Να γνωρίζει ορισμένες περιοδικές τάσεις των στοιχειών για τις πρώτες τρεις περιόδους.
- Να διακρίνει τα στοιχεία μετάπτωσης και να αναφέρει και να εξηγεί τις χαρακτηριστικές ιδιότητές τους.
- Διδάσκων: Γιώργος Βελώνιας
Χημεία Β' Λυκείου
Ενότητα 2.5: Αλκένια - αιθένιο ή αιθυλένιο
ΔΙΔΑΚΤΙΚΟΙ ΣΤΟΧΟΙ:
Με το πέρας της διδασκαλίας θα πρέπει να έχεις επιτεύξει τα παρακάτω μαθησιακά αποτελέσματα:
- Να αναγνωρίζεις τις πολλαπλές αναπαραστάσεις ενός οργανικού μορίου αλλά και ενός πολυμερούς (μοριακός τύπος, συντακτικός τύπος, μοριακό μοντέλο).
- Να αναγράφεις τους συντακτικούς τύπους που αντιστοιχούν σε ένα μοριακό τύπο υδρογονάνθρακα.
- Να μπορείς να ονομάσεις ένα αλκένιο όταν σου δίνεται ο μοριακός ή συντακτικός τύπος, σύμφωνα με τους κανόνες ονοματολογίας.
- Να προβλέπεις και να σχεδιάζεις τους συντακτικούς τύπους των ισομερών που αντιστοιχούν σε έναν μοριακό τύπο υδρογονάνθρακα.
- Να συμπληρώνεις τις χημικές εξισώσεις τέλειας καύσης των αλκενίων.
- Να μπορείς να γράφεις τις χημικές εξισώσεις των αντιδράσεων προσθήκης Η2, Βr2, HCl, H2 O στα αλκένια και να χρησιμοποιείς τον κανόνα του Markovnikov για τα προβλέψεις τα επικρατέστερα προϊόντα.
- Να αναγνωρίζεις ένα πολυμερές και τις δομικές μονάδες από τις οποίες αποτελείται.
- Να μπορείς να συνδέεις τις αντιδράσεις πολυμερισμού με υλικά που χρησιμοποιείς στην καθημερινή σου ζωή και να γράφεις τις εξισώσεις πολυμερισμού του αιθενίου, του προπενίου και του βινυλοχλωριδίου.
- Διδάσκων: Nikos Kalogeropoulos
- Διδάσκων: Παναγιώτα Δούρου
- Διδάσκων: Αρετή Παπαδιώτη
Χημεία Β' Λυκείου
Ενότητα 4.1 - Κορεσμένα μονοκαρβοξυλικά οξέα - Αιθανικό οξύ
|
ΣΤΟΧΟΙ: Στο τέλος αυτής της διδακτικής ενότητας θα πρέπει να μπορείς:
|
Διδακτικές ώρες: 4

- Διδάσκων: Ρουάιντα Αλσάουα
- Διδάσκων: Σοφία Τριβέλλα
Χημεία Γ' Γυμνασίου
"Οξέα - Βάσεις - Εξουδετέρωση (Οι Βάσεις & Εξουδετέρωση)"
Κεφάλαια 1.2-1.3
Στο προηγούμενο κεφάλαιο έγινε παρουσίαση των οξέων. Σε αυτήν την ενότητα θα ασχοληθούμε με τις βάσεις. Τα οξέα και οι βάσεις είναι δύο οικογένειες χημικών ενώσεων που χρησιμοποιούμε συχνά στην καθημερινή ζωή. Επιπλέον, θα μελετήσουμε το φαινόμενο της εξουδετέρωσης, δηλαδή τη χημική αντίδραση που πραγματοποιείται, όταν αναμειγνύεται ένα οξύ με μία βάση.
Στο τέλος της ενότητας αυτής, εκτιμάται πως οι μαθητές θα είναι σε θέση να :
- διαπιστώνουν τον βασικό χαρακτήρα ουσιών που περιέχονται σε προϊόντα του άμεσου περιβάλλοντός τους
- ορίζουν τις βάσεις κατά Arrhenius
- γράφουν τους χημικούς τύπους ορισμένων βάσεων, όταν δίνονται τα ονόματά τους
- διαπιστώνουν πειραματικά τον όξινο ή τον βασικό χαρακτήρα ενός διαλύματος με τη χρήση δεικτών
- ταξινομούν τα διαλύματα ανάλογα με το pH σε όξινα, βασικά και ουδέτερα
- χειρίζονται με ευχέρεια τη διαδικασία «πρόβλεψη-πειραματικός έλεγχος-εξήγηση» ως βασικό πυρήνα της πειραματικής διαδικασίας
- χρησιμοποιούν εργαστηριακά όργανα και σκεύη της χημείας καθώς και λογισμικά και ΤΠΕ
- μετράνε στο εικονικό εργαστήριο το pH όξινων και βασικών διαλυμάτων με το πεχαμετρικό χαρτί και το ηλεκτρονικό πεχάμετρο
- ορίζουν το φαινόμενο της εξουδετέρωσης
- ερμηνεύουν την εξουδετέρωση αναγράφοντας τη σχετική χημική εξίσωση

- Διδάσκων: Δέσποινα Καλύβα
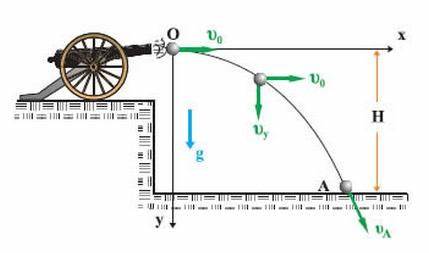
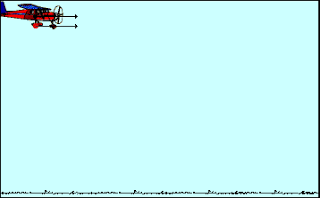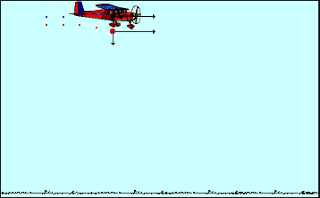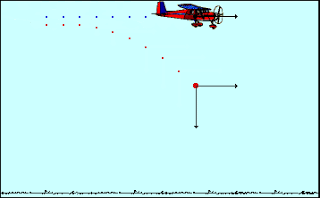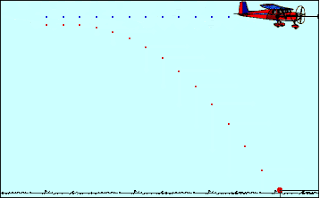
Το φαινόμενο της Οριζόντιας Βολής απαντάται πολλές φορές στην καθημερινότητα του ανθρώπου, με πολλές μορφές, για αυτό και είναι μεγάλης σημασίας η κατανόησή του από τους μαθητές.
Στόχοι Μαθήματος:
Οι μαθητές, με την επαφή τους με το κεφάλαιο της οριζόντιας βολής, θα πρέπει:
1. Να μπορούν να περιγράφουν τα παρατηρούμενα φαινόμενα της συγκεκριμένης κίνησης.
2. Να διατυπώνουν την Αρχή της Ανεξαρτησίας και να διακρίνουν τις κινήσεις από τις οποίες συντίθεται η οριζόντια βολή.
3. Να έχουν την ευχέρεια να αναλύουν την οριζόντια βολή στις επιμέρους κινήσεις, δηλαδή στην ευθύγραμμη ομαλή κίνηση και την ελεύθερη πτώση και να χρησιμοποιούν τις εξισώσεις που περιγράφουν τη συνολική κίνηση και τις επιμέρους κινήσεις για την επίλυση ασκήσεων.
4. Να κατανοούν ποια μεγέθη παραμένουν σταθερά και ποια μεταβάλλονται κατά τη διάρκεια της κίνησης.
5. Να διαπιστώνουν τις σχέσεις εξάρτησης και αναλογίας που συνδέουν τα επιμέρους μεγέθη.
6. Να εξοικειωθούν με τις έννοιες: εξίσωση της τροχιάς, παραβολική τροχιά, βεληνεκές, χρόνος πτήσης.
7. Να μπορούν να χρησιμοποιούν διαδραστικό οπτικό υλικό για να διεξάγουν διαδικτυακά πειράματα, όπως υπαγορεύουν οι παρούσες συνθήκες εκπαίδευσης, αλλά και να οπτικοποιήσουν τη θεωρία που διδάσκεται.
8. Να έχουν τη δυνατότητα να παραστήσουν γραφικά τις μετρήσεις που λαμβάνουν από τη διεξαγωγή των πειραμάτων και να εξάγουν συμπεράσματα βασισμένα στη θεωρία.
Η διδασκαλία που έχετε στα χέρια σας αποτελείται από τέσσερα σκέλη:
1ο Μάθημα:
Γνωριμία με το φαινόμενο της Οριζόντιας Βολής.
Ανασκόπηση βασικών εννοιών και κινήσεων της Α' Λυκείου που θα μας φανούν χρήσιμες.
Ανάλυση των εννοιών και των εξισώσεων που περιγράφουν το φαινόμενο.
2ο Μάθημα:
Επίλυση ασκήσεων
3ο Μάθημα:
Συμπλήρωση Φύλλου Εργασίας.
4ο Μάθημα:
Γραπτή Αξιολόγηση στο κεφάλαιο της Οριζόντιας Βολής.
- Διδάσκων: Νικόλαος Χατζηκωνσταντίνου
Χημεία Α' Λυκείου: Κεφ.2.2
H σπουδαιότερη ίσως έμμεση απόδειξη της ηλεκτρονιακής δομής των ατόμων - στοιχείων είναι ο περιοδικός πίνακας. Το ιστορικό της ανακάλυψης, της συμπλήρωσης (που είναι ίσως ακόμη «ανοικτή») και της ερμηνείας του αποτελούν βασικές γνώσεις για τη διαμόρφωση της χημικής σκέψης.
Στόχοι:
Στο τέλος αυτής της διδακτικής ενότητας ο μαθητής θα πρέπει να μπορεί:
- Να εξιστορεί την εξέλιξη καθώς και την ανάγκη ταξινόμησης των στοιχείων στον περιοδικό πίνακα.
- Να περιγράφει τον σύγχρονο περιοδικό πίνακα. Πιο συγκεκριμένα, να ξέρει να ορίζει τι είναι ομάδα και περίοδος και να μπορεί να τις απαριθμεί, καθώς και να αναφέρει παραδείγματα στοιχείων, εντοπίζοντας τη θέση τους στον περιοδικό πίνακα.
- Να αναγνωρίζει την αρχή που δομείται ο σύγχρονος περιοδικός πίνακας και να τη συνδέει με τη λογική της ηλεκτρονιακής δόμησης των ατόμων. Κατ΄ επέκταση, να μπορεί να συνδέει τη χημική συμπεριφορά ενός στοιχείου με τη θέση του στον περιοδικό πίνακα.
- Διδάσκων: Μαριάννα-Στυλιανή Καραμήτρου
Στόχοι του μαθήματος:
- Ο μαθητής να έχει κατανοήσει την έννοια της ατμοσφαιρικής ρύπανσης, ποιες ανθρώπινες δραστηριότητες συμβάλλουν σε αυτή και τι επιπτώσεις έχει.
- Ο μαθητής να γνωρίζει τι είναι ρυπαντές, καθώς και τους φωτοχημικούς ρύπους.
- Ο μαθητής να γνωρίζει την σημασία του στρώματος του όζοντος, τι είναι η τρύπα του όζοντος, πώς δημιουργήθηκε και τι επιπτώσεις έχει.
- Ο μαθητής να γνωρίζει τι είναι οι χλωροφθοράνθρακες και πώς επηρεάζουν το στρώμα του όζοντος.
- Ο μαθητής να έχει κατανοήσει τον τρόπο λειτουργίας του φαινομένου του θερμοκηπίου, ποιες ανθρώπινες δραστηριότητες ανατρέπουν τη θετική του επίδραση και τι
περιβαλλοντικά προβλήματα δημιουργούν.
- Ο μαθητής να ξεχωρίζει τα αέρια που συμμετέχουν στο φαινόμενο του θερμοκηπίου.

- Διδάσκων: Ευγενία Ραφτοπούλου
- Διδάσκων: Μυρτώ Συμεωνίδου
Περιγραφή
Σε αυτό το μάθημα θα παρουσιαστεί το κεφάλαιο 1.2 του σχολικού βιβλίου με τίτλο "Κύτταρο: Η μονάδα της ζωής". Συγκεκριμένα, ο μαθητής στο κεφάλαιο αυτό εξοικειώνεται με την έννοια του κυττάρου, την δομή του καθώς και τις λειτουργίες που αυτό επιτελεί.
Διδακτικοί Στόχοι
Ο μαθητής στο τέλος των διδακτικών ωρών θα πρέπει να είναι σε θέση:
- Να γνωρίζει τις διαφορές μεταξύ μονοκύτταρων και πολυκύτταρων οργανισμών .
- Να περιγράφει τη δομή του κυττάρου και τις λειτουργίες των κυτταρικών οργανιδίων.
- Να διακρίνει τις δοκιμές και λειτουργικές διαφορές μεταξύ ζωικών και φυτικών κυττάρων.
- Να αναγνωρίζει τα οργανίδια στο μικροσκόπιο.
- Έμβιοι Οργανισμοί
- Χαρακτηριστικά Οργανισμών
Διδακτικές Ώρες : 5

- Διδάσκων: Αλεξάδρα Γκαρτζονίκα
- Διδάσκων: Νεφέλη-Ελευθερία Καραγιαννοπούλου
Χημεία Β' Γυμνασίου
Ενότητες:
- Τι είναι η Χημεία και γιατί την μελετάμε
- Καταστάσεις των Υλικών
- Φυσικές Ιδιότητες Υλικών
3 Διδακτικές Ώρες
- Διδάσκων: Νικόλαος Ιωάννου
ΔΙΔΑΚΤΙΚΟΙ ΣΤΟΧΟΙ
2.1 Το νερό στην ζωή μας
Με το πέρας αυτής της διδακτικής ενότητας οι μαθητές θα πρέπει να:
- Εκτιμά την μεγάλη σημασία του νερού για την δημιουργία και την διατήρηση της ζωή στον πλανήτη
- Να ανιχνεύει πειραματικά το νερό σε στερεά, υγρά και αέρια σώματα
- Να αναφέρει καθημερινές ανάγκες της ανθρώπινης κοινωνίας σε νερό
2.2 Το νερό ως διαλύτης- Μείγματα
Με το πέρας αυτής της διδακτικής ενότητας οι μαθητές θα πρέπει να:
- Παρασκευάζουν μείγματα διαφόρων ουσιών
- Να διακρίνουν αν ένα μείγμα είναι ομογενές ή ετερογενές
- Να διαπιστώνουν πειραματικά την ιδιότητα του νερού να διαλύει πολλές ουσίες
- Να ορίζουν τι είναι διάλυμα και να αναφέρει παραδείγματα
- Να ονομάζουν τον διαλύτη και την διαλυμένη ή διαλυμένες ουσίες σε ένα διάλυμα, όταν γνωρίζουν την σύσταση του
Διδάσκοντες: Μαλαπάνη Χριστίνα, Ζυγολάνη Ελισάβετ-Ραφαηλία

- Διδάσκων: Χριστίνα Μαλαπάνη
Στο πλαίσιο του μαθήματος θερμοδυναμικής Β' λυκείου, θα μελετηθούν τα παρακάτω:
- Σύστημα και περιβάλλον, θερμοδυναμικό σύστημα, ισορροπία θερμοδυναμικού συστήματος, αντιστρεπτές μεταβολές, έργο - θερμότητα - εσωτερική ενέργεια
- Α΄ θερμοδυναμικό αξίωμα και εφαρμογές
- θερμικές μηχανές
- Β΄ θερμοδυναμικό αξίωμα, Κύκλος Carnot
Διδάσκοντες: Αίγλη λουκαντζίκου, Παναγιώτης Ταβουλάρης, Νίκος Χατζόπουλος
Ώρες διδασκαλίας: 6
- Διδάσκων: Αίγλη Λουκατζίκου
- Διδάσκων: Παναγιώτης Ταβουλάρης
- Διδάσκων: Νικόλαος Χατζόπουλος
Σύνθεση συγγραμικών δυνάμεων, ο πρώτος νόμος του Νεύτωνα, ο δεύτερος νόμος του Νεύτωνα ή θεμελιώδης νόμος της Μηχανικής και η δύναμη του βάρους.
ΔΙΔΑΚΤΙΚΟΙ ΣΤΟΧΟΙ
Μετά το πέρας της διδασκαλίας, ο στόχος του μαθήματος είναι όλοι οι μαθητές να είναι σε θέση:
- Να αντιλαμβάνονται τη δύναμη ως διανυσματικό μέγεθος.
- Να ξεχωρίζουν τη διαφορά μεταξύ του μέτρου δύναμης και της αλγεβρική τιμή της δύναμης.
- Να αθροίζουν αλγεβρικά ομόρροπες και αντίρροπες δυνάμεις.
- Να αντιλαμβάνονται τον 1ο νόμο του Νεύτωνα και την έννοια της αδράνειας.
- Να αντιλαμβάνονται τη σχέση μεταξύ δύναμης-μάζας-επιτάχυνσης όπως αυτή ορίζεται από το 2ο νόμο του Νεύτωνα
- Να αντιλαμβάνονται την έννοια του βάρους και να το ταξινομούν ως μία μορφή δύναμης.
Χρήστος Πασχάλης, Δημήτριος Γιαννούλας, Ιωάννης Τοπιτάρτσης
Διδακτικές ώρες: 8

- Διδάσκων: Δημήτριος Γιαννούλας
- Διδάσκων: Χρήστος Πασχάλης
• Να εξηγήσουν ποιος είναι ο σ και ποιος ο π δεσμός και να μπορούν αν τους αναγνωρίσουν σε διάφορα μόρια
• Να εξηγήσουν τί είναι ο υβριδισμός.
• Να διακρίνουν τα διάφορα υβριδικά τροχιακά και να καθορίζουν τη γεωμετρία τους. Να αναγνωρίζουν τη γεωμετρία ορισμένων μορίων με βάση τη θεωρία υβριδισμού
• Να ερμηνεύσουν τον απλό δεσμό C-C, τον διπλό δεσμό C=C και τον τριπλό δεσμό C≡C

- Διδάσκων: Δημήτριος Γιαννούλας
- Διδάσκων: Λουβουλίνα Μαρία
- Διδάσκων: Ιωάννης Τοπιταρτσης
- Διδάσκων: ʼρης-Γεώργιος Κυριαζής
- Διδάσκων: Μαγδαληνή Παπαδοπούλου
- Διδάσκων: Αχιλλέας-Αντώνιος Συργιανίδης
Θεωρία
Γίνεται εισαγωγή στις έννοιες της σύμπλοκης ένωσης και σύμπλοκου ιόντος, αλλά και στο σχηματισμό τους (σταθερά σχηματισμού, σταθερά αστάθειας). Στη συνέχεια, παρουσιάζονται οι χηλικές ενώσεις, ενώ γίνεται εμβάθυνση στο EDTA, λόγω της εξαιρετικής του συμπλεκτικής του ικανότητας με τα περισσότερα μεταλλοϊόντα. Ακολούθως, παρατίθενται τα βασικότερα χαρακτηριστικά των συμπλοκομετρικών καμπυλών τιτλοδότησης, αλλά και των μεταλλόχρωμων δεικτών. Τέλος, εισάγονται τεχνικές αποσκλήρυνσης του νερού, αλλά και οι μέθοδοι υπολογισμού του βαθμού σκληρότητάς του (αγγλικοί, γαλλικοί, γερμανικοί βαθμοί σκληρότητας).
Εργαστήριο
Βασικό στόχο της εργαστηριακής άσκησης αποτελεί η παρουσίαση των συμπλοκομετρικών τιτλοδοτήσεων ως κατάλληλων μεθόδων προσδιορισμού της σκληρότητας του νερού. Πιο συγκεκριμένα, οι φοιτητές καλούνται να προσδιορίσουν τη σκληρότητα ενός δείγματος εμφιαλωμένου νερού, χρησιμοποιώντας ως πρότυπο διάλυμα το EDTA.
- Διδάσκων: Θεόδωρος Κατσουγιάννης
- Διδάσκων: Καλλιόπη Μενεγάκη

- Διδάσκων: Νεφέλη-Μαρία Καυκούλα
- Διδάσκων: Νικόλαος Κωνσταντίνου
Αμυντικοί μηχανισμοί- Τρόπος ζωής και ασθένειες
Στο μάθημα αυτό παρέχεται η δυνατότητα απόκτησης καινούριων γνώσεων σχετικά με ποιους τρόπους αμύνεται το ανθρώπινο σώμα απέναντι στους παθογόνους μικροοργανισμούς.
Στόχοι του μαθήματος:
- Ο μαθητής να έχει κατανοήσει πλήρως την λειτουργία των αμυντικών μηχανισμών
- Ο μαθητής να μπορεί να κάνει διάκριση ανάμεσα στους εξωτερικούς και εσωτερικούς αμυντικούς και να αναφέρει ορισμένους σημαντικούς από αυτούς σε κάθε κατηγορία
- Ο μαθητής να έχει κατανοήσει πλήρως τη ζωτική λειτουργία των εμβολίων και τον ορών και πώς αυτά συμβάλλουν στη απόκτηση ανοσίας του ανθρώπινου οργανισμού.
- Ο μαθητής να γνωρίζει πώς σχετίζεται ο τρόπος ζωής με ορισμένες ασθένειες που οφείλονται σε εξαρτησιογόνες ουσίες και τι συνέπειες προκαλούνται στον ανθρώπινο οργανισμό από τη επανειλημμένη χρήση τους.
- Ο μαθητής να γνωρίζει τις απαραίτητες ενέργειες που πρέπει να εφαρμόσει κάποιος τυχόν χρήστης, προκειμένου να καταπολεμήσει τις επιβλαβείς ουσίες και να βελτιώσει σε μεγάλο βαθμό την υγεία του.
Απαιτούμενες γνώσεις:
Δεν απαιτούνται απαιτούμενες γνώσεις!
Ώρες διδασκαλίας: 6 ώρες
Διδάσκοντες: Κωνσταντίνος Ουζούνογλου, Γεώργιος Βραδής, Αριστοτέλης Γεωργόπουλος
- Διδάσκων: Γιώργος Βραδής
- Διδάσκων: Αριστοτέλης Γεωργόπουλος
- Διδάσκων: Κωσταντίνος Ουζούνογλου
Στόχοι του μαθήματος:
• Η εκμάθηση του τρίτου Νόμου του Νεύτωνα, Νόμος Δράσης-Αντίδρασης.
• Ο διαχωρισμός των δυνάμεων σε δυνάμεις εξ επαφής και εξ αποστάσεως.
• Η ικανότητα σύνθεσης αλλά και ανάλυσης δυνάμεων.
• Η κατανόηση της ισορροπίας ομοεπίπεδων δυνάμεων.
• Η εκμάθηση του Νόμου και των ειδών της Τριβής
Ώρες διδασκαλίας: 6 ώρες

- Διδάσκων: Αφροδίτη Αλεξοπούλου
- Διδάσκων: Πηνελόπη Ελευθερίου
- Διδάσκων: Λυδία Κιαχάκη
Στο συγκεκριμένο μάθημα διδάσκονται οι εξής διδακτικές ενότητες με βάση το βιβλίο της Χημείας Γ' Λυκείου Β' Τεύχος:
4.2. Παράγοντες που επηρεάζουν την θέση της Χημικής Ισορροπίας - Αρχή Le Chatelier
4.3. Σταθερά Χημικής Ισορροπίας Kc - Kp.
Σκοπός του μαθήματος είναι η εξοικείωση των μαθητών με τους παράγοντες που μπορούν να επηρεάσουν την πορεία μιας αμφίδρομης αντίδρασης και αφομοίωση αυτών με ιδιαίτερη έμφαση στην Αρχή Le Chatelier και στην σταθερά χημικής ισορροπίας Kc.
Στόχοι μαθήματος
Να διατυπώνουν την Αρχή Le Chatelier.
Να αναφέρουν ονομαστικά τους βασικούς παράγοντες που επηρεάζουν τη χημική ισορροπία.
Να εξηγούν την επίδραση της μεταβολής θερμοκρασίας στην ισορροπία.
Να εξηγούν την επίδραση της μεταβολής της πίεσης σε μια ισορροπία.
Να ορίζουν την Kc σε ομογενείς και ετερογενείς αντιδράσεις.
Να υπολογίζουν ποσότητες ουσιών σε ισορροπία με τη βοήθεια της Kc .
Να εξηγούν την επίδραση της θερμοκρασίας στην σταθερά ισορροπίας (Kc) και στην απόδοση της αντίδρασης.
Να προσδιορίζουν την κατεύθυνση της αντίδρασης μέσω του πηλίκου Qc.
Να υπολογίζουν την απόδοση ή την σύσταση του μίγματος στην ισορροπία.
Διδακτικές Ώρες: 6 ώρες
Διδάσκων: Μαρία - Άρτεμις Εριπαρέλη, Κωνσταντίνος Ιωάννου, Λουκία Κατσούλη
- Διδάσκων: Μαρία-Άρτεμις Εριπαρέλη
- Διδάσκων: Κωνσταντίνος Ιωάννου
- Διδάσκων: Κατσούλη Λουκία
Περιγραφή μαθήματος
Στο μάθημα αυτό θα παρουσιαστεί η ενότητα 3.2 από το σχολικό βιβλίο της Χημείας της Γ Λυκείου. Ειδικότερα ,από την ενότητα «Χημική Κινητική » οι μαθητές θα διδαχθούν τους παράγοντες που επηρεάζουν την ταχύτητα μιας αντίδρασης και τη δράση των καταλυτών .
Στόχοι μαθήματος
Ο μαθητής θα πρέπει μετά το πέρας της διδασκαλίας:
- Να γνωρίζει ποιοι είναι οι παράγοντες που επηρεάζουν την ταχύτητα μιας αντίδρασης, πως την επηρεάζουν και να κατανοήσει κάποιες πρακτικές εφαρμογές τους.
- Να γνωρίζει αναλυτικά την δράση των καταλυτών και των ενζύμων, την θεωρία προσρόφησης και την θεωρία των ενδιάμεσων προϊόντων.
Εργαστήριο
Στην εργαστηριακή άσκηση θα μελετηθούν τρεις από τους παράγοντες συγκεκριμένα η συγκέντρωση, η επιφάνεια επαφής στερεού και η θερμοκρασία. Οι μαθητές θα κληθούν να διαλύσουν ένα αναβράζον δισκίο και να μετρήσουν το χρόνο πραγματοποίησης της αντίστοιχης αντίδρασης αλλάζοντας κάθε φορά έναν από τους παραπάνω παράγοντες.
Διδάσκοντες: Στέφα Άννα, Τσόπελα Αγγελική Διδακτικές ώρες: 5

- Διδάσκων: Αννα Στέφα
- Διδάσκων: Αγγελική Τσόπελα
- Διδάσκων: Μαγδαληνή Τσιαμπούρη
- Διδάσκων: Ειρήνη Παλαιολόγου
- Διδάσκων: Κωνστανίνος Χαλάτσης
- Διδάσκων: Θάλεια-Βασιλική Κωτούλα
- Διδάσκων: Δανάη Λαζαρίδη
Η διδασκόμενη ύλη περιλαμβάνει τον χημικό δεσμό, τους παράγοντες που καθορίζουν τη χημική συμπεριφορά του ατόμου (ηλεκτρόνια σθένους και ατομική ακτίνα), τα είδη των χημικών δεσμών (ιοντικός και ομοιοπολικός) και τη δομή Lewis.
Στόχοι του μαθήματος είναι οι μαθητές και οι μαθήτριες:
-Να μπορούν να εξηγούν τι είναι ο χημικός δεσμός
-Να διακρίνουν τα κυριότερα είδη χημικών δεσμών (ομοιοπολικός και ετεροπολικός)
-Να συνδέουν τις ιδιότητες των χημικών ουσιών (χημικών στοιχείων και ενώσεων) με τα είδη χημικών δεσμών
-Να γράφουν τις δομές Lewis των ενώσεων
Διδακτικές ώρες: 8

- Διδάσκων: Άρτεμις Ζαφειράκη
- Διδάσκων: Κωνσταντίνα Κατσάρου
- Διδάσκων: Μαρκέλλα Μαρκατάτου

- Διδάσκων: Αικατερίνη Αλεξανδρή
- Διδάσκων: Ελευθερία Βαρέση
- Διδάσκων: Χριστίνα Ευθυμίου
Οι διδακτικοί στόχοι της ενότητας είναι οι μαθητές:
1. Να κατανοούν τι μπορεί να είναι ένας οργανισμός.
2. Να γνωρίζουν ποια είναι η βασική μονάδα της ζωής και την δομή της.
3. Να γνωρίζουν σε τι διαφέρουν τα φυτικά και τα ζωικά κύτταρα.
4. Να γνωρίζουν τις διαφορές μονοκύτταρων και πολυκύτταρων οργανισμών.
5. Να γνωρίζουν τον ρόλο των μελών του κυττάρου και να μπορούν να τα εντοπίσουν σε ένα κύτταρο.
6. Να εξοικειωθούν με τους κανόνες εργασίας και ασφάλειας στο εργαστήριο Βιολογίας, τα όργανα και συσκευές ενός σχολικού εργαστηρίου, και με το μικροσκόπιο ως βασικό εργαλείο σε ένα εργαστήριο Βιολογίας.
Διδακτικές ώρες: 4
- Διδάσκων: Ιωάννης Δοντάς
- Διδάσκων: Απόστολος Τσουμάνης

- Διδάσκων: Φοίβος Παναγιώτου
- Διδάσκων: Μάριος Σπύρου
- Διδάσκων: Ανθούσα Σιγανού
- Διδάσκων: Ευαγγελία Χρονοπούλου
Στόχοι Μαθήματος
Προαπαιτούμενες γνώσεις
Έννοιες Κλειδιά
Διδακτικές ώρες:
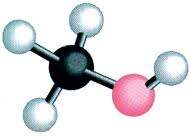
- Διδάσκων: Ήριννα Ιωαννίδη-Καλλέργη
- Διδάσκων: Μαρία Ιωάννου
- Διδάσκων: Δωροθέα Θεοδωρόπουλου
- Διδάσκων: Ιωάννα Μανώλη
- Διδάσκων: Φωτεινή Χαχάμη
- Διδάσκων: Μιχάηλ Χριστοδούλου
Περιγραφή του μαθήματος
Το μάθημα αποσκοπεί στην εξοικείωση των μαθητών με τις εισαγωγικές έννοιες τις οργανικής χημείας. Πιο συγκεκριμένα η διδασκόμενη ύλη περιλαμβάνει: 1. Εισαγωγή, Θεωρία Δεσμού Σθένους, 2. Σίγμα και Πι δεσμοί, 3. Υβριδισμός, 4. Απλός, Διπλός, Τριπλός δεσμός, 5. Επαγωγικό Φαινόμενο
Στόχοι του μαθήματος
- να αναγνωρίζουν την θεωρία δεσμού σθένους και μέσα από αυτή να κατανοήσουν τον σ και τον π δεσμό
- να γνωρίζουν τι σημαίνει υβριδισμός και πως αυτός επηρεάζει τις οργανικές ενώσεις
- να διακρίνουν τον απλό, τον διπλό και τον τριπλό δεσμό και να γνωρίζουν σε ποια μόρια και χημικές ενώσεις συναντώνται
- να κατανοήσουν το επαγωγικό φαινόμενο, ερμηνεύοντας κάποιες ιδιότητες χημικών ενώσεων
Λέξεις κλειδιά
θεωρία δεσμού σθένους, επικάλυψη, τροχιακά, θεμελιώδης κατάσταση, σ δεσμός, π δεσμός, υβριδισμός, απλός - διπλός - τριπλός δεσμός, ενέργεια δεσμού, μήκος δεσμού, επαγωγικό φαινόμενο, υποκαταστάτες
Διδακτικές ώρες
6 ώρες

- Διδάσκων: Μαρία Παγώνη
- Διδάσκων: Βάρβαρα Παλαιοθοδώρου
- Διδάσκων: Ειρήνη Τσιλιγιάννη
Με το πέρας της διδασκαλίας ο μαθητής πρέπει να μπορεί:
· Να αναφέρει ότι ενώσεις με διαφορετικό χρώμα στην μοριακή και ιοντική τους μορφή μπορούν να παίζουν το ρόλο των πρωτολυτικών δεικτών.
· Να προβλέπει τις πιθανές χρήσεις των δεικτών στον (χρωματομετρικό) προσδιορισμό της τιμής pH διαλυμάτων.
· Να υπολογίζει λόγο και να εκτιμά το χρώμα του διαλύματος στο οποίο προστίθεται μικρή ποσότητα του δείκτη.
· Να αναγνωρίζει τη δυνατότητα ποσοτικού προσδιορισμού διαλυμάτων οξέων ή βάσεων με ογκομέτρηση με πρότυπα διαλύματα.
· Να αναφέρει ποια είναι η ογκομετρική μέθοδος.
· Να εφαρμόζει την οξυμετρία-αλκαλιμετρία για τον έλεγχο εμπορικών προϊόντων π.χ. ξυδιού.
· Να υπολογίζει την περιοχή τιμών pH (συνήθως 2 μονάδες) μέσα στην οποία αλλάζει χρώμα ο δείκτης.
· Να κατασκευάζει τις καμπύλες ογκομέτρησης ως γραφικές παραστάσεις της σχέσης pH=f(V), όπου V ο όγκος του προστιθέμενου πρότυπου αντιδραστηρίου.
· Να επιλέγει τον κατάλληλο δείκτη μέσα από την καμπύλη ογκομέτρησης και το ισοδύναμο σημείο.
· Να αξιοποιεί τα δεδομένα μιας καμπύλης ογκομέτρησης, δηλαδή της γραφικής παράστασης της σχέσης pH=f(Vπροτύπου).
· Να υπολογίζει την άγνωστη συγκέντρωση διαλύματος οξέος ή βάσης από κατάλληλα αριθμητικά δεδομένα της ογκομέτρησης.
· Να υπολογίζει το pH όταν έχει προστεθεί ορισμένη ποσότητα προτύπου και τις σταθερές ιοντισμού του διαλύματος οξέος ή βάσης.
Προαπαιτούμενες γνώσεις:
Οι μαθητές θα πρέπει να:
1) Μπορούν να βρίσκουν το pH σε ένα ιοντικό διάλυμα
2) Μπορούν να αναγνωρίζουν τα οξέα και τις βάσεις σύμφωνα με την θεωρία των Bronsted-Lowry και να τα/τις κατατάσσουν σε ισχυρά/ες και ασθενή/είς
3) Γνωρίζουν τον μηχανισμό των αντιδράσεων εξουδετέρωσης
4) Γνωρίζουν την έννοια των ρυθμιστικών διαλυμάτων
5) Μπορούν να διατυπώνουν την σχέση της σταθερά ιοντισμού και να την χρησιμοποιούν για υπολογισμούς
6) Έχουν ευχέρεια στην χρήση των σχέσεων Henderson-Hasselbalch
Διδακτικές ώρες: 5

- Διδάσκων: Κωνσταντίνα Μαυροπούλου
- Διδάσκων: Γεώργιος Μικεδάκης
Χημεία Γ'Λυκείου
Ηλεκτρονιακή δομή των ατόμων και περιοδικός πίνακας
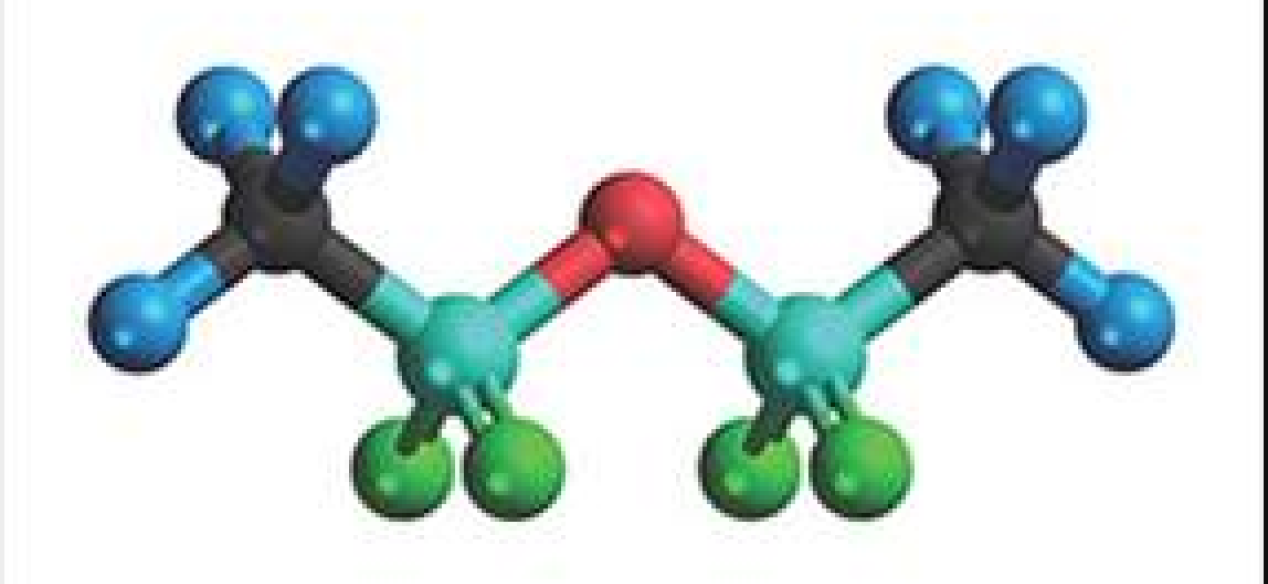
6.2: Αρχές δόμησης πολυηλεκτρονιακών ατόμων
6.3: Δομή περιοδικού πίνακα (τομείς s, p, d, f)- στοιχεία μετάπτωσης
Περιγραφή μαθήματος:
Καθοδήγηση των μαθητών στην ανακάλυψη της σχέσης μεταξύ ηλεκτρονιακής δομής και θέσης στον περιοδικό πίνακα αλλά κυρίως στην ερμηνεία της περιοδικότητας των χημικών ιδιοτήτων των στοιχείων .
Στόχοι:
- Να γνωρίζεις τις αρχές ηλεκτρονιακής δόμησης
- Να μπορείς να γράφεις την ηλεκτρονιακή δομή οποιουδήποτε ατόμου, αν γνωρίζεις τον ατομικό του αριθμό
- Να ταξινομείς τα στοιχεία ανάλογα με την ηλεκτρονιακή τους δόμηση στους τομείς s, p, d και f του περιοδικού πίνακα
- Να διακρίνεις την περιοδικότητα των στοιχείων
- Να αιτιολογείς τις χαρακτηριστικές ιδιότητες των στοιχείων μεταπτώσεως
- Να αιτιολογείς τα θεμελιώδη χαρακτηριστικά του ατόμου: την ατομική ακτίνα και την ενέργεια ιοντισμού
Λέξεις-κλειδιά:
Απαγορευτική αρχή του Pauli, αρχή ελάχιστης ενέργειας, κανόνας του Hund, νόμος περιοδικότητας, τομείς περιοδικού πίνακα, στοιχεία μετάπτωσης, ατομική ακτίνα, ηλεκτραρνητικότητα, ενέργεια ιοντισμού
Ώρες διδασκαλίας:
6 διδακτικές ώρες
- Διδάσκων: Φιλίππα Γιακουμή
- Διδάσκων: Φαίδρα Κυριακοπούλου
- Διδάσκων: Βασίλης Παμπορίδης
- Διδάσκων: Βασιλική Σούλη
- Διδάσκων: Οδυσσέας Χατζηθεοδώρου
Περιγραφή Μαθήματος
Στην ενότητα αυτή θα μελετηθεί η έννοια της χημικής αντίδρασης και οι βασικές κατηγορίες χημικών αντιδράσεων.
Συγκεκριμένα θα μελετηθεί:
- Ο συμβολισμός των χημικών αντιδράσεων και η ισοστάθμισή τους
- Προϋποθέσεις πραγματοποίησης μιας χημικής αντίδρασης
- Είδη Χημικών Αντιδράσεων:
- Οξειδοαναγωγικές Αντιδράσεις
- Αντιδράσεις Σύνθεσης
- Αντιδράσεις Αποσύνθεσης και Διάσπασης
- Αντιδράσεις Απλής Αντικατάστασης
- Μεταθετικές Αντιδράσεις
- Αντιδράσεις Διπλής Αντικατάστασης
- Εξουδετέρωση
Ώρες διδασκαλίας: 7

- Διδάσκων: ΑΥΓΟΥΣΤΙΝΟΣ ΙΩΑΝΝΟΥ
- Διδάσκων: ΚΛΕΟΝΙΚΗ ΙΩΑΝΝΟΥ
- Διδάσκων: ΕΛΕΝΗ ΚΑΡΑΧΑΛΙΟΥ
- Διδάσκων: ΕΙΡΗΝΗ MΠΕΚΙΑΡΗ
- Διδάσκων: ΑΘΗΝΑ ΜΠΟΥΖΙΩΤΗ
 Περιγραφή
Περιγραφή
Σε αυτή την ενότητα οι μαθητές θα διδαχθούν τους παράγοντες που επηρεάζουν τη χημική συμπεριφορά των ατόμων, την αγωγιμότητα, τον χημικό δεσμό και τα είδη του, ιοντικό και ομοιοπολικό.

Στόχοι μαθήματος:
Με το πέρας της διδασκαλίας πρέπει οι μαθητές:
• Να έχουν κατανοήσει και να μπορούν να ορίζουν ποιοι είναι οι παράγοντες που καθορίζουν την χημική συμπεριφορά.
• Να κατανοούν την ερμηνεία της αγωγιμότητας και να αναφέρουν παραδείγματά της, όπως αυτά που διδάχθηκαν στην προσομοίωση.
• Να κατανοούν τις έννοιες του ιοντικού και του ομοιοπολικού δεσμού (πολωμένου και μη πολωμένου) και να τους περιγράφουν.
• Να ξεχωρίσουν τα είδη των δεσμών.
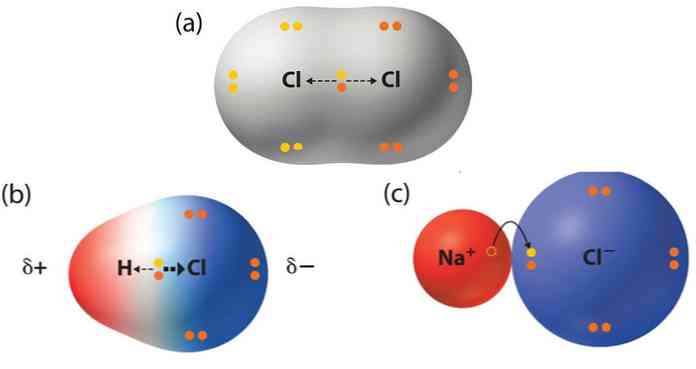
- Διδάσκων: Εβινά Γεωργαρίου
- Διδάσκων: Νίκη Διαμαντοπούλου
Ενότητα 2.2: Κατάταξη των στοιχείων - Περιοδικός Πίνακας
Περιγραφή Μαθήματος
Στο μάθημα αυτό θα διδαχθείτε την ενότητα 2.2 του σχολικού βιβλίου της Χημείας Α' Λυκείου. Συγκεκριμένα θα μάθετε για την έννοια του Περιοδικού Πίνακα. Αρχικά, θα συζητήσουμε για την σημασία της συνεισφοράς του Mendeleev και στην συνέχεια θα μιλήσουμε για την δομή του Σύγχρονου Περιοδικού Πίνακα και την σχέση της θέσης ενός στοιχείου στον Περιοδικό Πίνακα με την ηλεκτρονιακή του δομή.
Διδακτικές Ώρες
Το μάθημα θα ολοκληρωθεί σε 7 διδακτικές ώρες.
Στόχοι Μαθήματος
- Μετά το τέλος της διδασκαλίας θα:
- κατανοείτε την έννοια του περιοδικού πίνακα και τη σημασία του έργου του Mendeleev
- κατανοείτε την ταξινόμηση των στοιχείων στον σύγχρονο περιοδικό πίνακα
- είστε εξοικειωμένοι με τις έννοιες της ομάδας και της περιόδου του περιοδικού πίνακα
- μπορείτε να συνδέσετε τη θέση ενός στοιχείου στον περιοδικό πίνακα με την ηλεκτρονιακή του δομή
- μπορείτε να αντλήσετε πληροφορίες για τα χαρακτηριστικά και τις ιδιότητες ενός στοιχείου από τον περιοδικό πίνακα
- γνωρίζετε τη σημασία του περιοδικού πίνακα
Προαπαιτούμενες γνώσεις
- Από προηγούμενα μαθήματα πρέπει να μπορείτε να κατανέμετε τα ηλεκτρόνια ενός στοιχείου σε στιβάδες.

- Διδάσκων: Ελευθερία Βερυκάκη
- Διδάσκων: Μαρία-Δέσποινα Δίπλα
- Διδάσκων: Παναγιώτα Καραβαγγέλη
- Διδάσκων: Αγγελική Μελέα
- Διδάσκων: Ελένη Παπαγεωργοπούλου
Με το πέρας της διδασκαλίας πρέπει οι μαθητές:
▪ Να αποδίδουν τον πολυμερισμό με χημικές εξισώσεις και προσομοιώματα
▪ Να γνωρίζουν την έννοια του πολυμερισμού
▪ Να διακρίνουν τα πλαστικά από τα πολυμερή
▪ Να αναγνωρίζουν το χημικό τύπο της αιθανόλης και να γνωρίζουν της ιδιότητές της
▪ Να χρησιμοποιούν και να υπολογίζουν τους αλκοολικούς βαθμούς για οποιοδήποτε αλκοολούχο ποτό.
▪ Να γνωρίζουν τις συνέπειες κατανάλωσης οινοπνεύματος και το πώς επιδρά η αιθανόλη στον ανθρώπινο οργανισμό.
διδακτικές ώρες: 5
- Διδάσκων: Αλίκη Δεληνικολή
- Διδάσκων: Δέσποινα Δημουλά
Από το νερό στο άτομο- Από το μακρόκοσμο στο μικρόκοσμο: Άτομα και μόρια -Υποατομικά σωματίδια-Ιόντα
Οι επιστήμονες μας λένε ότι αποτελούνται από σωματίδια τα οποία ονομάζονται άτομα, άλλα είναι τόσο μικρά που δεν μπορούμε να τα δούμε με το μάτι μας. Συνεπώς, πώς μπορούμε να φανταστούμε τέτοια σωματίδια;
Σε αυτή την ενότητα, θα μάθουμε τι είναι τα άτομα και από τι αποτελούνται, θα μάθουμε να αναπαριστούμε άτομα με προσομοιώματα και σύμβολα, θα μάθουμε τι είναι τα μόρια, τα ιόντα, οι χημικές ενώσεις και τα χημικά στοιχεία και τέλος θα δούμε ένα πείραμα με το οποίο μπορούμε να επιβεβαιώσουμε ότι ουσίες γύρω μας αποτελούνται από μόρια ή ιόντα.

- Διδάσκων: Νικόλαος Κιντής
- Διδάσκων: Θεόδωρος-Μάριος Κολοκοτρώνης

- Διδάσκων: Αγγελική Νανά
- Διδάσκων: Ανδρεας Παπαμιχαηλ
- Διδάσκων: Ελενα Πιττακη

- Διδάσκων: Ανδρέας Νικοδήμου
- Διδάσκων: Ζαχαρίας Σεμερτζίδης
Συγκεκριμένα:
Στο τέλος της ενότητας 2.10, ο μαθητής θα μπορεί να:
• Αναγνωρίζει και να γράφει τα σύμβολα διαφόρων χημικών στοιχείων και χημικών ενώσεων.
• Διακρίνει τη ποιοτική σύσταση και την αναλογία ατόμων χημικών ενώσεων από τους αντίστοιχους μοριακούς τύπους.
Η ενότητα 2.11 αποσκοπεί:
• Στην αναπαράσταση διαφόρων απλών χημικών αντιδράσεων με τη χρήση προσομοιωμάτων μορίων και χημικών εξισώσεων
• Στη διάκριση αντιδρώντων και προϊόντων σε μία χημική εξίσωση.
Απαιτούμενες ώρες διδασκαλίας: 4
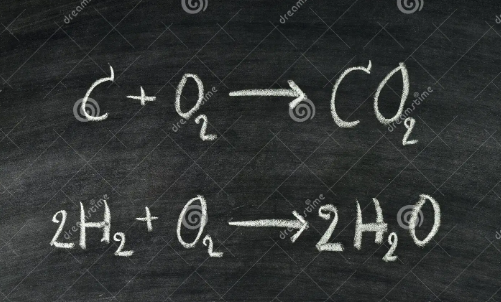
- Διδάσκων: Βασίλειος Κυριακόπουλος
- Διδάσκων: Φώτιος Λαντζούνης

- Διδάσκων: Ορφάνη Σωσάννη
Καλώς ήρθατε στο μάθημα της Χημείας!
Στο μάθημα αυτό θα μελετήσουμε τον σπουδαίο επιστημονικό κλάδο της χημείας και θα ανακαλύψουμε τα μυστικά που κρύβονται πίσω από την ύλη και τις καταστάσεις της. Θα εξερευνήσουμε το ερώτημα τι είναι η χημεία και γιατί την μελετάμε, θα διερευνήσουμε τις καταστάσεις της ύλης και θα μελετήσουμε τις φυσικές ιδιότητες των υλικών. Μαζί θα εξερευνήσουμε τα μυστικά που κρύβονται στον κόσμο της χημείας και θα ανακαλύψουμε τα εργαλεία που χρησιμοποιούν οι χημικοί για να αποκαλύψουν τα μυστικά της ύλης. Είμαστε σίγουροι ότι αυτή η επιστημονική περιπέτεια θα είναι ενδιαφέρουσα και απολαυστική!

- Διδάσκων: Βασιλεία Θεοφίλου
- Διδάσκων: Άντρεα Ιάσονος
- Διδάσκων: Ειρήνη-Αικατερίνη Λουκέρη
- Διδάσκων: Δέσποινα Μάστορη
- Διδάσκων: Σαββας Ττοφαρης
- Διδάσκων: Ιωάννα Μπιλάλη
- Διδάσκων: Θεοφανία Νατούδη
Στο παρόν μάθημα, οι μαθητές θα έρθουν σε επαφή με τους βασικούς όρους του κλάδου της θερμοδυναμικής (όπως το θερμοδυναμικό σύστημα, την ισορροπία συστήματος και την αντιστρεπτότητα). Στη συνέχεια, θα συστηθούν στις βασικές μορφές ενέργειας (Έργο, Θερμότητα κι Εσωτερική Ενέργεια). Ακολούθως, θα μάθουν την ερμηνεία των βασικών νόμων που διέπουν την θερμοδυναμική και θα ασκηθούν στην εφαρμογή τους σε κάποιες βασικές περιπτώσεις, στις οποίες συμπεριλαμβάνονται και οι θερμικές μηχανές.

- Διδάσκων: Ζαχαρίας Κουρελής
- Διδάσκων: Ιωάννης Μπαρτσώτας

- Διδάσκων: Ελένη Νταλαπέρα
- Διδάσκων: Μαριάννα Πηνελόπη Φανουργιάκη
- Διδάσκων: Αναστάσιος Παναγιώτης Χατζάκης
Σκοπός Μαθήματος
Σκόπος του μαθήματος είναι η επαφή των μαθητών με την έννοια της ταχύτητας αντίδρασης και των παραγόντων που την επηρεάζουν. Η ταχύτητα μιας αντίδρασης εξαρτάται από τον αριθμό των αποτελεσματικών συγκρούσεων μεταξύ των αντιδρώντων μορίων. Είναι προφανές ότι οι παράγοντες που επηρεάζουν τον αριθμό αυτών των συγκρούσεων, επηρεάζουν και την ταχύτητα της αντίδρασης. Οι παράγοντες αυτοί θα μας απασχολήσουν το επόμενο διάστημα και είναι οι εξής:
- η συγκέντρωση των αντιδρώντων
- η πίεση, με την προϋπόθεση ότι ένα τουλάχιστον απ΄ τα αντιδρώντα σώματα είναι αέριο
- η επιφάνεια επαφής των στερεών
- η θερμοκρασία
- οι ακτινοβολίες
- οι καταλύτες
Μαθησιακοί Στόχοι
- Να καθορίζεις τους παράγοντες που επηρεάζουν την ταχύτητα της αντίδρασης και να εξηγείς την επίδραση αυτών στην ταχύτητα με βάση τη θεωρία των συγκρούσεων.
- Να περιγράφεις τα χαρακτηριστικά που έχει ένας καταλύτης. Να ταξινομείς τους καταλύτες σε κατηγορίες, δίνοντας χαρακτηριστικά παραδείγματα σε κάθε περίπτωση.
- Να εξηγείς τη δράση των καταλυτών με βάση τη θεωρία των ενδιάμεσων προϊόντων και τη θεωρία προσρόφησης και να αναφέρεις χαρακτηριστικά παραδείγματα εφαρμογών της κατάλυσης στη χημική βιομηχανία και βιοχημεία.

- Διδάσκων: Σταυρούλα Καπελέρη
- Διδάσκων: Σεραίνα-Σοφία Παπαγεωργίου
- Διδάσκων: Χριστίνα Μιχαλοπούλου
Περίληψη μαθήματος
- Διδάσκων: Αναστασία Γεωργακοπούλου
- Διδάσκων: Αναστασία Ιβανίδου
- Διδάσκων: Ορέστης Μπαρμπάτσης
- Διδάσκων: Αθηνά Ντώντη
- Διδάσκων: Μαρία Συρίγου
- Διδάσκων: Καλλίτσα Γκούμα
- Διδάσκων: Ναυσικά Γούτη
- Διδάσκων: Μαργαρίτα Νιάρχου
- Διδάσκων: Στέφανος Όμηρος Δεββές
- Διδάσκων: Ελένη Λιάκου
- Διδάσκων: Αναστασία Βερνάρδου
- Διδάσκων: Έλλη Καφούσια
test
html
- Διδάσκων: Αλεξάνδρα Μπιζύμη
- Διδάσκων: Κοραλλία Τζουγανάτου
- Διδάσκων: Σπυρίδον Τριχάς
- Διδάσκων: MARIA ANTONOGLOU
- Διδάσκων: IOANNIS BROUZOS
- Διδάσκων: SOFIA DEDOUSI
- Διδάσκων: GEORGIOS DRAKOS
- Διδάσκων: VASILIS EVRIPIOTIS
- Διδάσκων: MARIANTHI GKOLFI
- Διδάσκων: NIKOS KALOGEROPOULOS
- Διδάσκων: nikos kalogeropoulos
- Διδάσκων: ELENI KALOGIANNI
- Διδάσκων: STELLA KARAGIANNI
- Διδάσκων: EVANTHIA KARVELA
- Διδάσκων: LOUKAS KEMAVOR
- Διδάσκων: MARIA KOLIA
- Διδάσκων: BASILIKI MARGARITI
- Διδάσκων: FOTINI MAVROIDI
- Διδάσκων: MARINA MPASTOUNOPOULOU
- Διδάσκων: VASILII PAPAZOGLOU
- Διδάσκων: MARIA POULOU
- Διδάσκων: AIKATERINI RAGAZOU
- Διδάσκων: FLORA VLAHOU
- Διδάσκων: GEORGIA VLAHOU
- Διδάσκων: ALIKI ZENTEFI
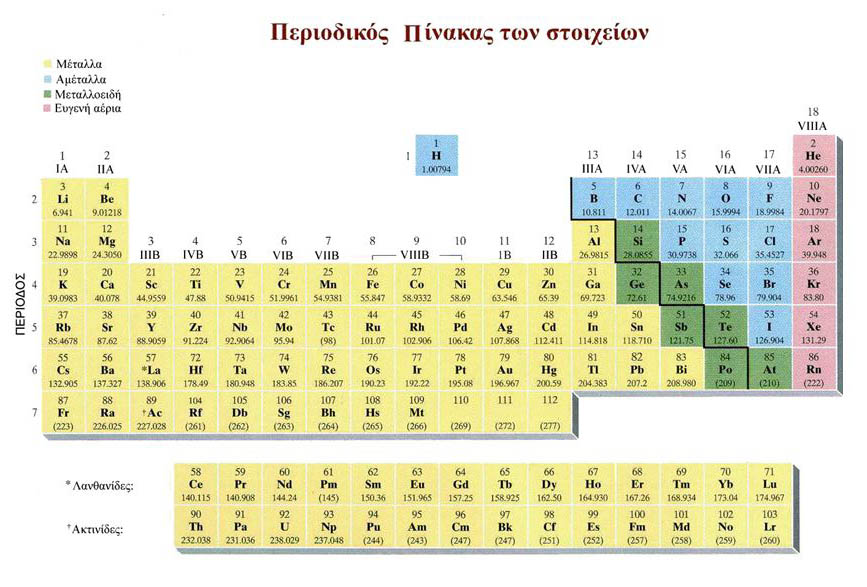
Το παρόν μάθημα αφορά στη διδασκαλία της ενότητας "Περιοδικός Πίνακας των Στοιχείων" της Α΄ τάξης του γενικού λυκείου.
Οι νέες εκπαιδευτικές τεχνολογίες που χρησιμοποιούνται επιχειρούν να καθοδηγήσουν τους μαθητές στην ανακάλυψη της σχέσης μεταξύ ηλεκτρονιακής δομής και θέσης στον περιοδικό πίνακα αλλά κυρίως στην ερμηνεία της περιοδικότητας των χημικών ιδιοτήτων των στοιχείων.
Η πραγματοποίηση του μαθήματος προσεγγίζεται σε 4 διδακτικές ώρες και στηρίζεται στο σχήμα πρόβλεψη- έλεγχος- συμπέρασμα και ανατροφοδότηση και απαιτεί υποστηρικτικό και καθοδηγητικό ρόλο από τον εκπαιδευτικό ενώ παράλληλα καλλιεργεί μεταγνωστικές δεξιότητες (αυτοέλεγχος, αυτοαξιολόγηση, αυτοδιόρθωση).
Χρησιμοποιήθηκαν ποικίλα διαδραστικά εργαλεία που συμβάλλουν στην ενεργή συμμετοχή των μαθητών με σκοπό την πρόκληση του ενδιαφέροντός τους και την απόκτηση θετικής στάσης απέναντι στο συγκεκριμένο μάθημα της Χημείας. Τα ιδιαίτερα χαρακτηριστικά πολυμεσικά εργαλεία αφορούν και εξωτερικούς συνδέσμους καθώς και εκπαιδευτικά παιχνίδια που αποδεδειγμένα επιφέρουν θετικό αποτέλεσμα στη μαθησιακή διαδικασία.
- Διδάσκων: Αλέξανδρος Ανδριάς
Η διδασκαλία με τίτλο "Άτομα και μόρια - Διδασκαλία με προσομοιώσεις" απευθύνεται σε μαθητές της Β' Γυμνασίου και επικεντρώνεται στην εκμάθηση των χημικών στοιχείων και των χημικών ενώσεων.
Οι μαθητές αναμένεται να αναπτύξουν τις ικανότητές τους στο να ξεχωρίζουν τις χημικές ουσίες από τις ενώσεις, να αναπαριστούν άτομα και μόρια, καθώς και να εξηγούν τη διάσπαση του νερού κατά την ηλεκτρόλυση.
Η διδακτική διαδικασία προβλέπει τη χρήση προσομοιώσεων μέσω του διαδικτύου, με σκοπό την ενίσχυση της κατανόησης και της ενεργούς συμμετοχής των μαθητών.
Ταυτόχρονα, η διαδικασία οργανώνεται ώστε να διεξάγεται σε ομάδες μαθητών, είτε σε εργαστήριο πληροφορικής είτε σε διαδραστικό πίνακα, προκειμένου να ενισχυθεί η συνεργατική εργασία και να επιτευχθεί η μέγιστη επίδραση της διδακτικής διαδικασίας.
Τέλος, η διάρκεια του σεναρίου εκτιμάται σε 3 διδακτικές ώρες, με την αξιοποίηση διαφορετικών προσομοιώσεων και πλατφορμών για την επίτευξη των εκπαιδευτικών στόχων.

- Διδάσκων: Ποθητη Αρβανιτακη
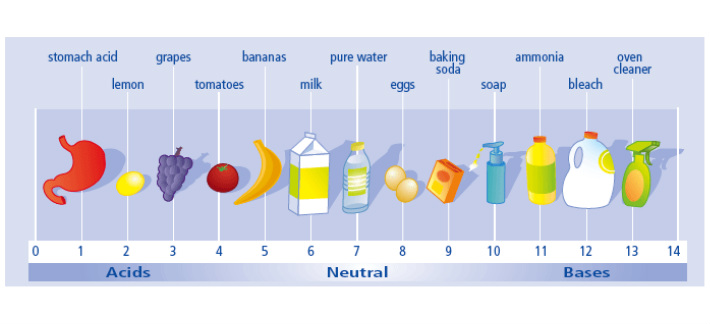
Το μάθημα Χημείας με τίτλο "Διδασκαλία οξέων, βάσεων, αλάτων και pH με χρήση ΤΠΕ" σχεδιάστηκε για μαθητές της Α' Λυκείου, με στόχο την ενίσχυση της κατανόησής τους σχετικά με τα οξέα, τις βάσεις, τα άλατα και την κλίμακα τιμών του pH. Τα προσδοκώμενα μαθησιακά αποτελέσματα περιλαμβάνουν την αναγνώριση των οξέων και των βάσεων βάσει του χημικού τύπου τους, τη διάκριση των ισχυρών οξέων/βάσεων από τα ασθενή, την πρόβλεψη της περιοχής του pH για κάποιες ενώσεις και την κατανόηση των μεταβολών του pH κατά την αραίωση ενός διαλύματος.
Η διδασκαλία οργανώνεται χρησιμοποιώντας διάφορα ψηφιακά μέσα και διαρκεί 4 διδακτικές ώρες. Οι μαθητές διανέμονται σε ομάδες 3-4 ατόμων και χρησιμοποιούν υπολογιστές στο εργαστήριο πληροφορικής. Κάθε μαθητής λαμβάνει ένα δικό του φύλλο εργασίας. Η διδασκαλία περιλαμβάνει τη χρήση διαδραστικών εφαρμογών και βίντεο για την ενίσχυση της κατανόησης.
Τα διαδραστικά βίντεο περιλαμβάνουν πειράματα ανίχνευσης οξέων και βάσεων από ουσίες της καθημερινότητας, εξηγήσεις για τα οξέα, τις βάσεις και την κλίμακα τιμών του pH, καθώς και προβολή πειραματικής διαδικασίας για τη μέτρηση του pH. Επιπλέον, δίνονται διαδραστικές εφαρμογές από το φωτόδεντρο και το phet-Colorado για ασκήσεις και εξάσκηση στην ονοματολογία ανόργανων ουσιών και τη μέτρηση του pH.
Μέσω αυτών των διδακτικών δραστηριοτήτων, οι μαθητές είναι σε θέση να επιτύχουν τα επιθυμητά μαθησιακά αποτελέσματα και να αναπτύξουν καλύτερη κατανόηση των οξέων, των βάσεων, των άλατων και της κλίμακας τιμών του pH.
- Διδάσκων: ΚΥΡΙΑΚΗ ΒΟΥΡΛΙΩΤΑΚΗ
Τα υποκεφάλαιο 2.8 και 2.9 του κεφαλαίου 2 με τα οποία θα ασχοληθούμε αναφέρονται στα άτομα, τα μόρια και τις προσομειώσεις τους και στα υποατομικά σωματίδια-ιόντα αντίστοιχα.
- Διδάσκων: ALIKI ZENTEFI
- Διδάσκων: GEORGIA VLAHOU

- Διδάσκων: MARIA POULOU
- Διδάσκων: Λιτσα Παυλάτου
- Διδάσκων: VASILII PAPAZOGLOU
- Διδάσκων: Λιτσα Παυλάτου
- Διδάσκων: MARINA MPASTOUNOPOULOU

- Διδάσκων: BASILIKI MARGARITI
- Διδάσκων: Λιτσα Παυλάτου
- Διδάσκων: AIKATERINI RAGAZOU
- Διδάσκων: Λιτσα Παυλάτου
- Διδάσκων: LOUKAS KEMAVOR

- Διδάσκων: Θεανώ Καλαούζη
- Διδάσκων: ELENI KALOGIANNI
Στα πλαίσια της 3ης εργασίας για το μάθημα " Εφαρμογή Νέων Τεχνολογιών" του ΔιΧηΝετ αναπτύσεται ένα διαδικτυακό εκπαιδευτικό περιβάλλον.To μάθημα το οποίο παρουσιάζεται είναι η Γενική Ενότητα "Η Χημεία του ΄Ανθρακα" που απευθύνεται σε μαθητές της Γ Γυμνασίου.

- Διδάσκων: MARIANTHI GKOLFI
- Διδάσκων: Λιτσα Παυλάτου
- Διδάσκων: GEORGIOS DRAKOS
Υπεύθυνη καθηγήτρια: Δεδούση Σοφία
Τάξη εκπάιδευσης: Α' Λυκείου
Διδακτικές ώρες :4
Διαθέσιμα μέσα: Ηλεκτρονικός υπολογιστής, Οπτικοακουστικά μέσα, Σχολικό βιβλίο
- Διδάσκων: SOFIA DEDOUSI
- Διδάσκων: MARIA ANTONOGLOU

- Διδάσκων: Nikos Kalogeropoulos
- Διδάσκων: Maria Koulou
- Διδάσκων: Λιτσα Παυλάτου
Στο κεφάλαιο αυτό θα ασχοληθούμε με τα κορεσμένα καρβοξυλικά οξέα και από αυτά ιδιαίτερα με το αιθανικό ή οξικό οξύ, δηλαδή το οξύ του ξυδιού. Θα ανακαλύψουμε τα καρβοξυλικά οξέα γύρω μας, θα αναφερθούμε στις ιδιότητες τους και θα δούμε ενδιαφέροντα πειράματα με αυτά. Τέλος, θα δούμε πως παρασκευάζεται το αιθανικό οξύ και γιατί είναι τόσο σημαντικό.

- Διδάσκων: Katerina Palivaki
Γενικά για το χημικό δεσμό. – Παράγοντες που καθορίζουν τη χημική συμπεριφορά του ατόμου. Είδη χημικών δεσμών (ιοντικός – ομοιοπολικός).
Στο μάθημα αυτό θα ασχοληθούμε με τη μελέτη :
- των ατομικών αλληλεπιδράσεων για τη δημιουργία του χημικού δεσμού
- τους παράγοντες
που καθορίζουν τη χημική συμπεριφορά των ατόμων: ατομική ακτίνα και ηλεκτρόνια
σθένους
- τη δημιουργία του ετεροπολικού δεσμού
- τη δημιουργία του ομοιοπολικού δεσμού
- τη αγωγιμότητα των υδατικών διαλυμάτων των ιοντικών ενώσεων
- Διδάσκων: Panagiotis Paraskevopoulos
- Διδάσκων: EVA GRAFANAKI
Το μάθημα αυτό είναι το πρώτο της Χημείας της Γ' γυμνασίου.
Ο σκοπός του περιεχόμενου της "1ης ενότητας: Οξέα - Βάσεις - Άλατα " είναι ο μαθητής να έρθει σε επαφή με τις έννοιες των Οξέων, των Βάσεων και των Αλάτων, να γνωρίζει κάποιες βασικές ιδιότητές τους και να μπορεί να διακρίνει σε ποιά κατηγορία από τις τρείς ανήκουν κάποιες χημικές ενώσεις.
Το πρώτο κεφάλαιο επικεντρώνεται στα Οξέα και στις ιδιότητές τους.

- Διδάσκων: Yvonnie Panidou

- Διδάσκων: ELPIDA Ntalakou
- Διδάσκων: Elpida Ntalakou
Ο 20ός αιώνας χαρακτηρίστηκε, όχι άδικα, αιώνας της ταχύτητας, γιατί παρατηρήθηκε μια έκρηξη στην ανάπτυξη των μεταφορών και της επικοινωνίας. Η ανάπτυξη της βιομηχανίας των αυτοκινήτων, των αεροπλάνων αλλά και των υπόλοιπων μεταφορικών μέσων δε θα μπορούσε να επιτευχθεί χωρίς την αξιοποίηση του πετρελαίου. Το πετρέλαιο ως καύσιμο χρησιμοποιείται και για τη θέρμανση και για την παραγωγή ηλεκτρικής ενέργειας για αστική, αγροτική και βιομηχανική χρήση. Όμως, όπως ανέφερε ο Mendeleev, «το πετρέλαιο είναι πολύ πολύτιμο για να καίγεται», γιατί αποτελεί την πρώτη ύλη για την παραγωγή πολλών χρήσιμων προϊόντων, όπως τα απορρυπαντικά, τα φάρμακα, τα πλαστικά και πολλά άλλα. Πολλές από τις γεωπολιτικές και οικονομικές ανακατατάξεις του 20ού αιώνα είχαν ως στόχο τον έλεγχο των κοιτασμάτων του πετρελαίου που χαρακτηρίστηκε μαύρος χρυσός.


- Διδάσκων: Georgios Daskalopoulos
- Διδάσκων: Athina Georgali
- Διδάσκων: EVA GRAFANAKI
- Διδάσκων: Maria Koulou
- Διδάσκων: ELPIDA Ntalakou
- Διδάσκων: Elpida Ntalakou
- Διδάσκων: Katerina Palivaki
- Διδάσκων: Yvonnie Panidou
- Διδάσκων: Panagiotis Paraskevopoulos
- Διδάσκων: Stefanos Pizzolhs
- Διδάσκων: Christina Tsouti
- Διδάσκων: Γιώργος Μπακαλάς
- Διδάσκων: Ευαγγελία Σωτηροπούλου
Διδακτικοί στόχοι
Σκοπός του μαθήματος είναι οι μαθητές να γνωρίζουν τον ορισμό των ρυθμιστικών διαλυμάτων και τη σημασία τους , να μπορούν να τα αναγνωρίζουν και να αναφέρουν τις ιδιότητες τους.
Ακόμη, θα πρέπει να είναι σε θέση να παρασκευάζουν ρυθμιστική διαλύματα, να υπολογίζουν το pH τους και να γράφουν τις αντίστοιχες χημικές εξισώσεις.
Επίσης να εφαρμόζει την εξίσωση Henderson και Hasselbalch στην περίπτωση αραίωσης ρυθμιστικού ή προσθήκης στο ρυθμιστικό μικρών ποσοτήτων ισχυρών οξέων ή βάσεων.
Τέλος να εφαρμόζει τα ρυθμιστικά διαλύματα σε φαινόμενα της καθημερινής ζωής.
Προαπαιτούμενες γνώσεις
- Οξέα-Βάσεις κατά Bronstend-Lowry
- Ιοντισμός οξέων-βάσεων, νερού- pH
- Επίδραση κοινού ιόντος

- Διδάσκων: Σεραφείμ Παπαγεωργίου
- Διδάσκων: Κωνσταντίνα Τζελέπη
- Διδάσκων: Χριστίνα Αλεξάκη
- Διδάσκων: Λυδία Τσιτσιμπή
- Διδάσκων: Δέσποινα Φλάρη
ΣΤΟΧΟΙ:
• Θα μάθετε να εφαρμόζετε τη Νευτώνεια φυσική στη συμπεριφορά των ρευστών.
• Θα μάθετε να χαρακτηρίζετε ένα ρευστό βάσει της πίεσης και της πυκνότητάς του.
• Θα διερευνήσετε τις δυνάμεις σε ένα ρευστό σε ισορροπία.
• Θα μάθετε να εκφράζετε τη διατήρηση της μάζας και της ενέργειας των ρευστών μέσω της εξίσωσης συνέχειας και της εξίσωσης Bernoulli.
• Θα δείτε εφαρμογές της δυναμικής των ρευστών που ποικίλλουν, από την ροή του αίματος έως την πτήση των αεροσκαφών και την εφαρμογή της άνωσης στα παγόβουνα.
• Θα μάθετε για την τριβή ρευστών ή ιξώδες.
ΠΡΟΑΠΑΙΤΟΥΜΕΝΕΣ ΓΝΩΣΕΙΣ:
• Γνώση του υπολογισμού της ολικής(συνισταμένης) δύναμης σε ένα σώμα όταν ασκούνται δύο ή περισσότερες δυνάμεις
• Γνώση τη εύρεσης της βαρυτικής δύναμης σε ένα σώμα.
• Εξοικείωση με τις εκφράσεις για την κινητική ενέργεια και τη βαρυτική δυναμική ενέργεια.
• Στοιχειώδεις γνώσεις Μαθηματικών και αριθμητικών πράξεων καθώς και επίλυση αλγεβρικών εξισώσεων.
• Πολύ καλή γνώση Φυσικής των προηγούμενων τάξεων.
ΔΙΔΑΚΤΙΚΟΙ ΣΤΟΧΟΙ:
• Να διατυπώνετε τους ορισμούς του ρευστού, του συμπιεστού και του ασυμπίεστου ρευστού, τον ορισμό της υδροστατικής πίεσης, τον θεμελιώδη νόμο της υδροστατικής πίεσης και την αρχή του Pascal, τους ορισμούς της στρωτής και της τυρβώδους ροής, τους ορισμούς της ρευματικής γραμμής, της φλέβας και της παροχής και την σχέση μεταξύ της ταχύτητας υγρού και παροχής.
• Να περιγράφετε τη λειτουργία του υδραυλικού πιεστηρίου και τις εφαρμογές της.
• Να αποδεικνύετε, να διατυπώνετε και να εφαρμόζετε την εξίσωση συνέχειας.
• Να εξηγείτε πως η εξίσωση Bernoulli είναι αποτέλεσμα της διατήρησης της ενέργειας.
• Να αποδεικνύετε, να περιγράφετε και να εφαρμόζετε την εξίσωση Bernoulli.
• Να αποδεικνύετε, να διατυπώνετε και να εφαρμόζετε την αρχή του Toricelli
ΔΙΔΑΚΤΙΚΕΣ ΩΡΕΣ:
Για την κάλυψη του συγκεκριμένου κεφαλαίου θα αξιοποιηθούν 6 ώρες. Μέρος από αυτές θα χρησιμοποιηθεί για την επίλυση ασκήσεων, κριτηρίων αξιολόγησης.

- Διδάσκων: Αλέξανδρος Σακελλαρίδης
- Διδάσκων: Ηλίας Χρονόπουλος

- Διδάσκων: Παναγιώτης Αλίκα
- Διδάσκων: Αλεξάνδρα Δημούδη
- Διδάσκων: Κατερίνα Μοσχαλη
- Διδάσκων: Φωτεινή Εφστρατιάδη
- Διδάσκων: Μπρούνο Ορτολανο
- Διδάσκων: Χριστόφορος Ράζος
- Διδάσκων: Κωνσταντίνος Τσοχαντζής
- Διδάσκων: Αντώνης Χασομέρης
- Διδάσκων: Ειρήνη Χρυσοβαλάντω Γατσά
- Διδάσκων: Ελένη- Ιωάννα Δημοπούλου
- Διδάσκων: Ναταλία Χαϊδόγιαννου
- Διδάσκων: Ιωάννης Κονσολάκης
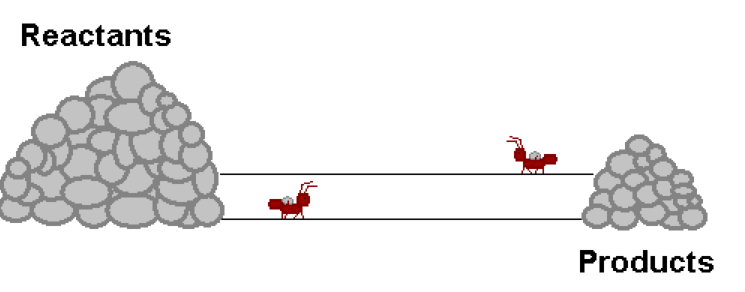
- Διδάσκων: Ευαγγελία Κολοβού
- Διδάσκων: Νικολέτα Κωστοπούλου
- Διδάσκων: Ευσταθία Σκουτέλη
- Διδάσκων: Ιωάννης Στεργιόπουλος
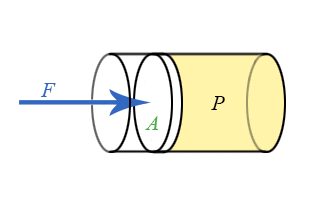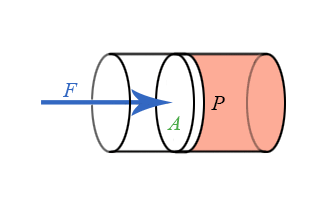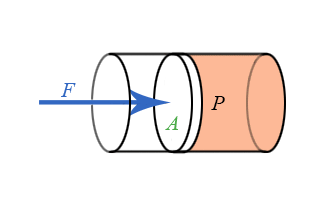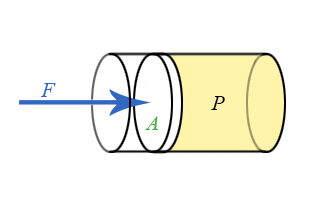
- Διδάσκων: Αναστάσιος Θωίδης
- Διδάσκων: Μιχαλης Πολυκάρπου
- Διδάσκων: Ανδρέας Στυλιανιδης
- Διδάσκων: Κωνσταντίνος Μυωτέρης
- Διδάσκων: Αλεξάνδρα Ροκανά
- Διδάσκων: Κρέων Παπατσάνης
- Διδάσκων: Ειρήνη Παρετζόγλου
- Διδάσκων: Ιωάννης Σινάνης
- Διδάσκων: Αθανάσιος Κατσακιώρης
- Διδάσκων: Ιωάννης Τζεγιαννάκης
- Διδάσκων: Εριφύλη Χριστοφορίδη
Περιγραφή :
Στο μάθημα αυτό θα ασχοληθούμε με την ενότητα 1.2 του σχολικού βιβλίου "Κύτταρό : η μονάδα της ζωής" .
Στόχοι του μαθήματος :
Με το τέλος της διδακτικής ενότητας ο μαθητής θα μπορεί :
- να περιγράφει την δομή του κυττάρου και τον τρόπο που αυτό λειτουργεί
- να αντιλαμβάνεται τις διαφορές μεταξύ μονοκύτταρων και πολυκύτταρων οργανισμών
- να περιγράφουν τις κύριες διαφορές ευκαρυωτικών & προκαρυωτικών κυττάρων και να αναγνωρίζουν ακυτταρικές μορφές ζωής (ιοί)
- να διακρίνει τα ζωικά και τα φυτικά κύτταρα βάση των χαρακτηριστικών τους
- να αντιλαμβάνεται την συνεισφορά των φυτικών κυττάρων στην αναπνοή των φυτών
- να αναγνωρίζει τα κύτταρα στο μικροσκόπιο και να εξοικειωθεί με την εργαστηριακή διαδικασία
Προαπαιτούμενες γνώσεις :
- Διάκριση έμβιων οργανισμών & άβιων αντικειμένων
- Τα χαρακτηριστικά των οργανισμών
Διδακτικές Ώρες : 5
- Διδάσκων: Νικολέττα Τρίχα
- Διδάσκων: Στυλιανή Τσαχρήστου
- Διδάσκων: Nikos Kalogeropoulos
- Διδάσκων: Δήμητρα Ηλιάδη
- Διδάσκων: Σαμπίνα Μουτσάι
- Διδάσκων: Νικόλαος Αγγελάκος
- Διδάσκων: Νικόλαος Καρούσος Θεοδωράκης
- Διδάσκων: Αικατερίνη Γκούμα
- Διδάσκων: Βασιλική Πιταρά
Διδακτικοί Στοίχοι
Οι μαθητές και οι μαθήτριες να μπορούν να συνδέουν τις γνώσεις τους για τα οξέα, τις αλκοόλες και την αντίδραση εστεροποίησης με τα λίπη και έλαια, να εξηγούν την απορρυπαντική δράση των σαπουνιών και να παρασκευάζουν σαπούνι στο εργαστήριο
Περιεχόμενο Μαθήματος:
Ενοτητα 1: Σαπωνοποίηση των τριγλυκεριδίων
Ενοτητα 2: Απορρυπαντική δράση των σαπώνων
Ενοτητα 3: Συνθετικά απορρυπαντικά
Διδακτικες ωρες: 3

- Διδάσκων: Μαριάνθη Λουκα
- Διδάσκων: ΒΑσίλειος Ντούρος
- Διδάσκων: Αναστασία Κραββαρη
- Διδάσκων: Αγγελική Μαρκοπούλου
- Διδάσκων: Ιωάννης Νάνος
- Διδάσκων: Ιωάννης Πενταγιώτης
- Διδάσκων: Γιάννης Αγγελούσης
- Διδάσκων: Ελευθερία Γερονίτη
- Διδάσκων: Κανίνια Φοίβη Έντουαρντς
- Διδάσκων: Αναστασία Ορφανούδη
- Διδάσκων: Γεωργία Κομβοπούλου
- Διδάσκων: Στεφανία Μάμαλη
- Διδάσκων: Βασιλική Πυροβολάκη
ΧΗΜΕΙΑ Γ ΛΥΚΕΙΟΥ
«Δομή οργανικών ενώσεων – διπλός και τριπλός δεσμός – Επαγωγικό φαινόμενο»
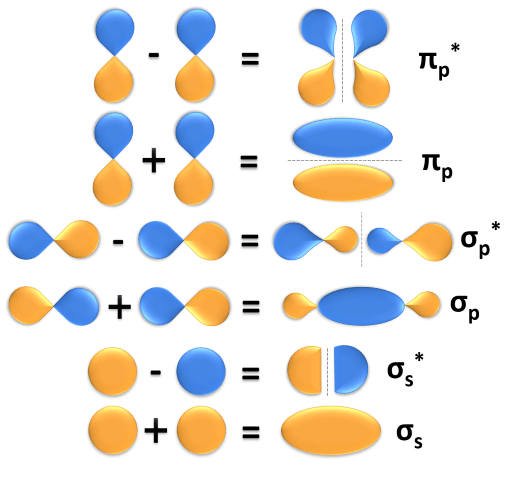
- Διδάσκων: Δήμητρα Καλφαντή
- Διδάσκων: Δανάη-Δήμητρα Μόρφη
- Διδάσκων: Ελευθερία Πουρνάρα
- Διδάσκων: Ανδριάνα Ρίζου
- Διδάσκων: Πηγή Σμυρλή
- Διδάσκων: Χαντζάρα Μαργαρίτα
- Διδάσκων: Νικολέτα Τότσι
- Διδάσκων: Αννα Μαρία Φραδελακη
- Διδάσκων: Κατερίνα Δελή
- Διδάσκων: Μαρία Ελένη Παυλάκη
- Διδάσκων: Αγάπη Φρονίστα

- Διδάσκων: Κώστας Βασιλείου
- Διδάσκων: Αθανάσιος Γκομές Ντε Φαρία
- Διδάσκων: Σταθώρης Στάθης
- Διδάσκων: Κωνσταντίνος Παυλής
- Διδάσκων: Αναστασία Σιαμπλή
- Διδάσκων: Αμαλία Ισμαΐλι
- Διδάσκων: Τανια Αγγουση
- Διδάσκων: Παναγιώτα Κοκκολιάδη
- Διδάσκων: Ιωάννα Χαρά Σίδερη
- Διδάσκων: Διονυσία Σπυροπούλου
- Διδάσκων: Γιώργος Κόλλιας
- Διδάσκων: Ξενοφών Μάρης
- Διδάσκων: Σπύρος Μπότσαρης

- Διδάσκων: Ανδρέας Λαός
- Διδάσκων: Παναγιώτα Πρωτοπαπά
- Διδάσκων: Χρίστος Χαραλάμπους
- Διδάσκων: Αγγελική Κανσού
- Διδάσκων: Μαρία Ιωάννα Λιλικάκη
- Διδάσκων: Ιφιγένεια Σωτηρία Καρλοβασίτη
- Διδάσκων: Βασιλική Κωνσταντίνα Μπαλούμη
- Διδάσκων: Γεώργιος Παπαδόπουλος
- Διδάσκων: Ελευθεριος Παπαϊωάννου
- Διδάσκων: Θεανώ Καλαούζη
Περίληψη μαθήματος kdsafkdkd
- Διδάσκων: Nikos Kalogeropoulos
- Διδάσκων: Νικόλαος Αγγελάκος
- Διδάσκων: Γιάννης Αγγελούσης
- Διδάσκων: Τανια Αγγουση
- Διδάσκων: Χριστίνα Αλεξάκη
- Διδάσκων: Παναγιώτης Αλίκα
- Διδάσκων: Δήμητρα Ελευθερία Αντωνάκου
- Διδάσκων: Κώστας Βασιλείου
- Διδάσκων: Ειρήνη Χρυσοβαλάντω Γατσά
- Διδάσκων: Ελευθερία Γερονίτη
- Διδάσκων: Αθανάσιος Γκομές Ντε Φαρία
- Διδάσκων: Αικατερίνη Γκούμα
- Διδάσκων: Κατερίνα Δελή
- Διδάσκων: Ελένη- Ιωάννα Δημοπούλου
- Διδάσκων: Αλεξάνδρα Δημούδη
- Διδάσκων: Κανίνια Φοίβη Έντουαρντς
- Διδάσκων: Φωτεινή Εφστρατιάδη
- Διδάσκων: Δήμητρα Ηλιάδη
- Διδάσκων: Αναστάσιος Θωίδης
- Διδάσκων: Αμαλία Ισμαΐλι
- Διδάσκων: Μαρία Καλογρίδη
- Διδάσκων: Δήμητρα Καλφαντή
- Διδάσκων: Αγγελική Κανσού
- Διδάσκων: Ιφιγένεια Σωτηρία Καρλοβασίτη
- Διδάσκων: Νικόλαος Καρούσος Θεοδωράκης
- Διδάσκων: Αθανάσιος Κατσακιώρης
- Διδάσκων: Παναγιώτα Κοκκολιάδη
- Διδάσκων: Γιώργος Κόλλιας
- Διδάσκων: Ευαγγελία Κολοβού
- Διδάσκων: Γεωργία Κομβοπούλου
- Διδάσκων: Ιωάννης Κονσολάκης
- Διδάσκων: Αναστασία Κραββαρη
- Διδάσκων: Ανδρέας Κωστόπουλος
- Διδάσκων: Δανάη Κωστοπούλου
- Διδάσκων: Νικολέτα Κωστοπούλου
- Διδάσκων: Ανδρέας Λαός
- Διδάσκων: Μαρία Ιωάννα Λιλικάκη
- Διδάσκων: Μαριάνθη Λουκα
- Διδάσκων: Στεφανία Μάμαλη
- Διδάσκων: Χαντζάρα Μαργαρίτα
- Διδάσκων: Ξενοφών Μάρης
- Διδάσκων: Αγγελική Μαρκοπούλου
- Διδάσκων: Κυριακή Μάτου
- Διδάσκων: Δανάη-Δήμητρα Μόρφη
- Διδάσκων: Κατερίνα Μοσχαλη
- Διδάσκων: Σαμπίνα Μουτσάι
- Διδάσκων: Βασιλική Κωνσταντίνα Μπαλούμη
- Διδάσκων: Σπύρος Μπότσαρης
- Διδάσκων: Κωνσταντίνος Μυωτέρης
- Διδάσκων: Ιωάννης Νάνος
- Διδάσκων: ΒΑσίλειος Ντούρος
- Διδάσκων: Μπρούνο Ορτολανο
- Διδάσκων: Αναστασία Ορφανούδη
- Διδάσκων: Γεώργιος Παπαδόπουλος
- Διδάσκων: Ελευθεριος Παπαϊωάννου
- Διδάσκων: Κρέων Παπατσάνης
- Διδάσκων: Μαρία Ελένη Παυλάκη
- Διδάσκων: Κωνσταντίνος Παυλής
- Διδάσκων: Ιωάννης Πενταγιώτης
- Διδάσκων: Βασιλική Πιταρά
- Διδάσκων: Δημήτριος Πιτσαρης
- Διδάσκων: Μιχαλης Πολυκάρπου
- Διδάσκων: Ελευθερία Πουρνάρα
- Διδάσκων: Παναγιώτα Πρωτοπαπά
- Διδάσκων: Χριστόφορος Ράζος
- Διδάσκων: Χρήστος Ρίγλης
- Διδάσκων: Ανδριάνα Ρίζου
- Διδάσκων: Αλεξάνδρα Ροκανά
- Διδάσκων: Αλέξανδρος Σακελλαρίδης
- Διδάσκων: Αναστασία Σιαμπλή
- Διδάσκων: Ιωάννα Χαρά Σίδερη
- Διδάσκων: Ιωάννης Σινάνης
- Διδάσκων: Ευσταθία Σκουτέλη
- Διδάσκων: Πηγή Σμυρλή
- Διδάσκων: Διονυσία Σπυροπούλου
- Διδάσκων: Σταθώρης Στάθης
- Διδάσκων: Ιωάννης Στεργιόπουλος
- Διδάσκων: Ανδρέας Στυλιανιδης
- Διδάσκων: Ιωάννης Τζεγιαννάκης
- Διδάσκων: Κωνσταντίνα Τζελέπη
- Διδάσκων: Νικολέτα Τότσι
- Διδάσκων: Νικολέττα Τρίχα
- Διδάσκων: Στυλιανή Τσαχρήστου
- Διδάσκων: Λυδία Τσιτσιμπή
- Διδάσκων: Κωνσταντίνος Τσοχαντζής
- Διδάσκων: Δέσποινα Φλάρη
- Διδάσκων: Αννα Μαρία Φραδελακη
- Διδάσκων: Αγάπη Φρονίστα
- Διδάσκων: Ναταλία Χαϊδόγιαννου
- Διδάσκων: Χρίστος Χαραλάμπους
- Διδάσκων: Αντώνης Χασομέρης
- Διδάσκων: Εριφύλη Χριστοφορίδη
- Διδάσκων: Ηλίας Χρονόπουλος
Η ισορροπία των οικοσυστημάτων, όπως ήδη γνωρίζουμε, ελέγχεται από ρυθμιστικούς μηχανισμούς, που μεταξύ άλλων περιορίζουν την υπερβολική αύξηση των διάφορων πληθυσμών. Ο άνθρωπος, σε αντίθεση με άλλα είδη του πλανήτη μας, κατάφερε να ξεπεράσει αυτούς τους μηχανισμούς, με αποτέλεσμα την υπεραύξηση του ανθρώπινου πληθυσμού κατά τα τελευταία τετρακόσια χρόνια. Δεν κατάφερε όμως να ξεπεράσει τα προβλήματα που δημιουργούν οι συνέπειες αυτής της αύξησης στο περιβάλλον.

- Διδάσκων: Χαρά Καντερέ