Περιεχόμενο μαθήματος:
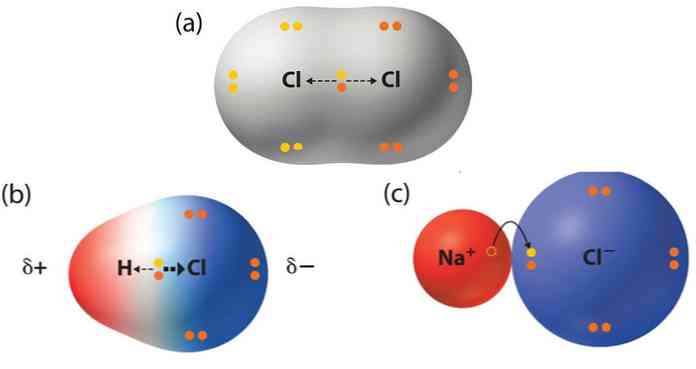
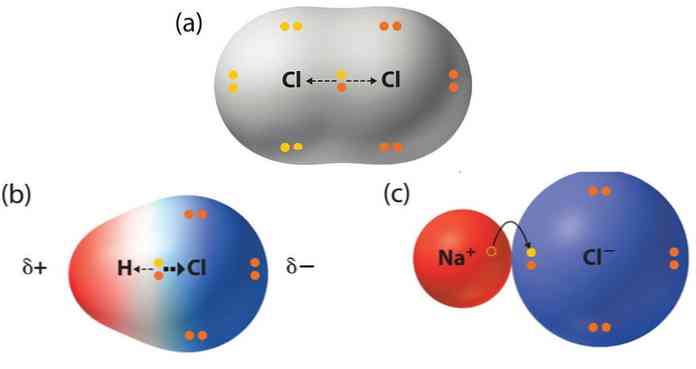
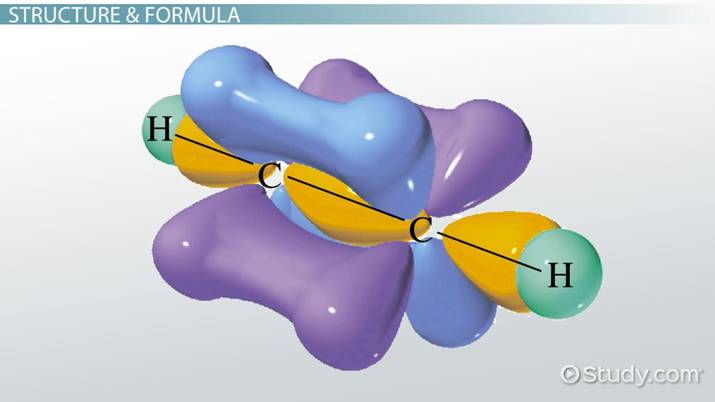
Οι οργανικές ενώσεις αποτελούνται κυρίως από άτομα άνθρακα που σχηματίζουν τέσσερις ομοιοπολικούς δεσμούς και δημιουργούν ευθείες ή διακλαδισμένες αλυσίδες και δακτυλίους. Όταν μεταξύ των ατόμων άνθρακα υπάρχουν πολλαπλοί δεσμοί, η ένωση λέγεται ακόρεστη. Ο διπλός δεσμός (C=C) αποτελείται από έναν σ-δεσμό και έναν π-δεσμό, ενώ ο τριπλός (C≡C) από έναν σ-δεσμό και δύο π-δεσμούς. Αυτοί οι δεσμοί επηρεάζουν τη γεωμετρία και τη χημική δραστικότητα των μορίων, με τους ακόρεστους δεσμούς να είναι πιο αντιδραστικοί από τους απλούς. Το επαγωγικό φαινόμενο αφορά τη μετατόπιση ηλεκτρονίων μέσω των σ-δεσμών λόγω διαφορών ηλεκτραρνητικότητας μεταξύ των ατόμων. Ανάλογα με τη φύση των ομάδων που συνδέονται με τον άνθρακα, το φαινόμενο μπορεί να είναι αρνητικό (–Ι) όταν απομακρύνουν ηλεκτρονική πυκνότητα, ή θετικό (+Ι) όταν την ωθούν προς τον άνθρακα. Το επαγωγικό φαινόμενο επηρεάζει σημαντικά τις ιδιότητες και τη συμπεριφορά των οργανικών ενώσεων.
Περιεχόμενο-σκοπός μαθήματος:
1)Να εξηγούν ποιος είναι ο σ και ποιος ο π δεσμός και να αναγνωρίζουν τα δύο αυτά είδη δεσμών σε ορισμένα μόρια
2)Να εξηγούν τι είναι υβριδισμός. Να διακρίνουν τις διάφορες κατηγορίες υβριδικών τροχιακών καθορίζοντας την γεωμετρική τους διάταξη και δίνοντας σχετικά παραδείγματα.
3)Να ερμηνεύουν με βάση τα παραπάνω τον σχηματισμό του απλού, διπλού και
τριπλού δεσμού .
4)Να αναγνωρίζουν την σημασία του επαγωγικού φαινομένου για την ερμηνεία ορισμένων ιδιοτήτων χημικών ενώσεων καθώς και του μηχανισμού ορισμένων αντιδράσεων.

- Teacher: Αλέξιος Προύντζος
- Teacher: Κλέανδρος Χορέβας














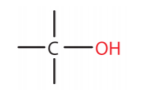
 .
.






















 Περιγραφή
Περιγραφή